
| A.Al | B.Al(OH)3 | C.AlCl3 | D.Al2O3 |
科目:高中化学 来源:不详 题型:单选题
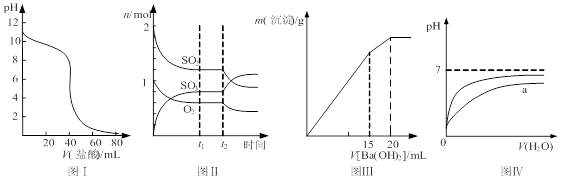
| A.图Ⅰ表示盐酸滴加到0.1 mol/L某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂 |
B.图Ⅱ表示一定条件下进行的反应2SO2+O2 2SO3 各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 2SO3 各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 |
| C.图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2溶液时铝离子恰好沉淀完全 |
| D.图Ⅳ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
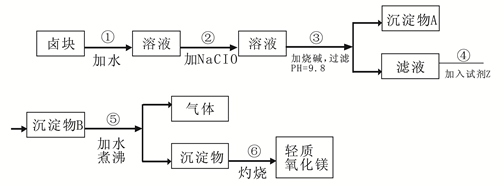
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 试剂 | 价格(元/吨) |
| 漂液(含NaClO,25.2%) | 450 |
| 双氧水(含H2O2 ,30%) | 2400 |
| 烧碱(含98% NaOH) | 2100 |
| 纯碱(含99.5% Na2CO3) | 600 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.甲、乙中都是铝过量 | B.甲中铝过量,乙中碱过量 |
| C.甲中酸过量,乙中铝过量 | D.甲中酸过量,乙中碱过量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2O2中阴、阳离子的个数比为1∶1 |
| B.Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等 |
| C.Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等 |
| D.Na2O2的漂白原理与SO2的漂白原理相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
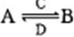 (在水溶液中进行)。其中C是产生温室效应的气体;D是淡黄色固体。写出C的结构式 ;D的电子式
(在水溶液中进行)。其中C是产生温室效应的气体;D是淡黄色固体。写出C的结构式 ;D的电子式 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.6.4g | B.8.0g | C.8.4g | D.9.2g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
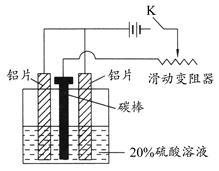
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com