(2013?江门一模)化工原料红矾钠(重铬酸钠:Na
2Cr
20
7-2H
20)主要是以铬铁矿(主要成份为FeO-Cr
2O
3,还含有A1
20
3,Si0
2等杂质)为主要原料生产,其主要工艺流程如图1:
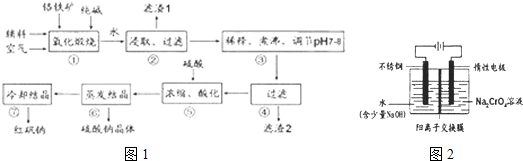
步骤①中主要反应的化学方程式为:Fe0?Cr
2O
3+8Na
2C0
3+70
2=8Na
2Cr0
4+2Fe
2O
3+8C0
2(I)①中反应是在回转窑中进行,反应时需不断搅拌,其作用是
增大反应物的接触面积,加快反应速率
增大反应物的接触面积,加快反应速率
.
(2)杂质A1
20
3,SiO
2在①中转化的化学反应方程式为
Al
2O
3+Na
2CO
32NaAlO
2+CO
2↑;SiO
2+Na
2CO
3Na
2SiO
3+CO
2↑
Al
2O
3+Na
2CO
32NaAlO
2+CO
2↑;SiO
2+Na
2CO
3Na
2SiO
3+CO
2↑
(3)用化学平衡移动原理说明③中煮沸的作用是
水解吸热,煮沸促进AlO2-+2H2O?Al(OH)3+OH-,SiO32-+H2O?HSiO3-+OH-水解平衡向右移动,生成氢氧化铝、硅酸沉淀
水解吸热,煮沸促进AlO2-+2H2O?Al(OH)3+OH-,SiO32-+H2O?HSiO3-+OH-水解平衡向右移动,生成氢氧化铝、硅酸沉淀
(用离子方程式结合文字说明),若调节pH过低产生的影响是
H+将水解生成的氢氧化铝沉淀溶解,杂质Al3+难与Na2CrO4分离
H+将水解生成的氢氧化铝沉淀溶解,杂质Al3+难与Na2CrO4分离
(4)⑤中酸化是使Cr0
42一转化为Cr
20
72一,写出该反应的离子方程式:
2CrO
42-+2H
+
Cr
2O
72-+H
2O
2CrO
42-+2H
+
Cr
2O
72-+H
2O
(5)工业上还可用电解法制备重铬酸钠,其装置示意图如图2:
阴极发生的电极反应式为:
阴极:4H2O+4e-═4OH-+2H2↑或2H2O+2e-═2OH-+H2↑
或4H++4e═2H2↑或2H++2e═H2↑
阴极:4H2O+4e-═4OH-+2H2↑或2H2O+2e-═2OH-+H2↑
或4H++4e═2H2↑或2H++2e═H2↑
阳极发生的电极反应式为:
阳极:2H2O-4e-═O2↑+4H+或4OH--4e-═O2↑+2H2O
阳极:2H2O-4e-═O2↑+4H+或4OH--4e-═O2↑+2H2O
.


 阅读快车系列答案
阅读快车系列答案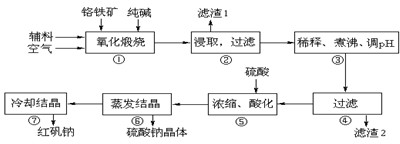
 Cr2O72-+H2O
Cr2O72-+H2O Cr2O72-+H2O
Cr2O72-+H2O

 Cr2O72-+H2O
Cr2O72-+H2O Cr2O72-+H2O
Cr2O72-+H2O