
已知:2SO2(g)+O2(g)
 2SO3(g)
△H=—196.6kJ·mol—1,向密闭容器中加入2mol SO2(g)和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如下图所示,下列说法正确的是( )
2SO3(g)
△H=—196.6kJ·mol—1,向密闭容器中加入2mol SO2(g)和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如下图所示,下列说法正确的是( )
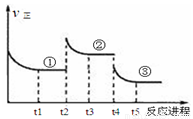
注:t1~t2、t3~t4、t5之后各时间段表示达到平衡状态①、②、③。
A.t2~t3时间段,平衡向逆反应方向移动
B.平衡状态①和②,平衡常数K值相同
C.平衡状态①和②,SO2转化率相同
D.t4时刻改变的条件是减小压强
科目:高中化学 来源: 题型:
| 0.1 | 0.5 | 1 | 10 |
400 | 99.2 | 99.6 | 99.7 | 99.9 |
500 | 93.5 | 96.9 | 97.8 | 99.3 |
600 | 73.7 | 85.8 | 89.5 | 96.4 |
(1) 已各SO2的氧化是放热反应,如何利用表中数据推断此结论?
(2)在大400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是____。
(3)选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量? (填“是”或“否”);
(4)为提高SO3吸收率,实际生产中用 吸收SO3;
(5)已知:2SO2(g)+O2(g)=2SO3(g);△H=-196.9kJ?mol-1,计算每生产1万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):

(1)已知SO2的氧化是放热反应,如何利用表中数据推断此结论?
_____________________________________________________________________
(2)在400~500 ℃时,SO2的催化氧化采用常压而不是高压,主要原因是:___________;
(3)选择适宜的催化剂,是否可以提高SO2的转化率?___________(填“是”或“否”),是否可以增大该反应所放出的热量?___________(填“是”或“否”);
(4)为提高SO3吸收率,实际生产中用___________吸收SO3;
(5)已知:2SO2(g)+O2(g)===2SO3(g) ΔH=-196.6 kJ·mol-1,计算每生产1万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁省铁岭市六校协作高三第三次联合考试化学试卷(解析版) 题型:填空题
(9分)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,也可用NH3处理,也可用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下2.24L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
(2)已知:2SO2(g)+O2(g)
 2SO3(g) ?H="-196.6"
kJ·mol-1
2SO3(g) ?H="-196.6"
kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ?H="-113.0"
kJ·mol-1
2NO2(g) ?H="-113.0"
kJ·mol-1
(ⅰ)则反应NO2(g)+SO2(g) SO3(g)+NO(g)的?H= kJ·mol-1。
SO3(g)+NO(g)的?H= kJ·mol-1。
(ⅱ)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
A.每消耗1 mol SO3的同时生成1 mol NO2 B. 体系压强保持不变
C. 混合气体颜色保持不变 D. SO3和NO的体积比保持不变
(ⅲ)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图(左)所示。平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)


(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应?H 0(填“>”或“ <”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应?H 0(填“>”或“ <”)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖南长沙望城区一中高三第四次调研考试化学试卷 题型:填空题
研究NO2、SO2、CO等大气污染气体的处理有重要意义。
(1)NO2可用水吸收,相应的化学方程式为______。
利用反应6NO2+8NH3  7N2+12H2O
7N2+12H2O
也可以处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是______L。
(2)已知:2SO2(g)+ O2
(g) 2SO3 (g) △H =-196.6kJ·mol-1
2SO3 (g) △H =-196.6kJ·mol-1
2NO(g)+ O2 (g)  2NO2 (g) △H =-113.0kJ·mol-1
2NO2 (g) △H =-113.0kJ·mol-1
则反应NO2(g)+ SO2 (g)  SO3 (g) +NO(g) △H =______kJ·mol-1
SO3 (g) +NO(g) △H =______kJ·mol-1
一定条件下,将体积比为1:2的 NO2和 SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3与NO的体积比保持不变 d.每消耗1molSO3的同时生成1molNO2
测得上述反应平衡时的NO2与SO2体积比为1:6,则平衡常数K=______。
(3)CO可用于合成甲醇,反应方程式为CO(g)+ 2H2 (g)  CH3OH (g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应△H _____0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________。
CH3OH (g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应△H _____0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________。

查看答案和解析>>
科目:高中化学 来源:09-10学年衡中高二下学期第二次调研考试化学试卷 题型:选择题
下列说法或表示方法正确的是( )
A.反应物的总能量低于生成物的总能量时,该反应一定不能发生
B.化学键和分子间作用力都对物质的性质有一定的影响
 C.已知:2SO2 (g) + O2
(g) 2SO3 (g) ;△H = -98.3
kJ/mol。将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ 的热量
C.已知:2SO2 (g) + O2
(g) 2SO3 (g) ;△H = -98.3
kJ/mol。将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ 的热量
D.由石墨比金刚石稳定可知:C(金刚石,s)= C(石墨,s) ;△H<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com