
【题目】与NO3-互为等电子体的是
A. SO3 B. P4 C. PCl3 D. NO2
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】由两种金属组成的混合物4.8g,跟氯气完全反应时,消耗氯气2.24L(标准状况),则混合物的组成可能是
A. 镁和铁 B. 钠和铁 C. 锌和锅 D. 锌和铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】优良的有机溶剂对孟烷、耐热型特种高分子功能材料PMnMA的合成路线如下:

己知芳香化合物苯环上的氢原子可被卤代烷中的烷基取代.如:
![]()
(1)B为芳香烃.
①由B生成对孟烷的反应类型是__.
②(CH3)2CHCl与A生成B的化学方程式是__.
③A的同系物中相对分子质量最小的物质是__.
(2)1.08g的C与饱和溴水完全反应生成3.45g白色沉淀.E不能使Br2的CCl4溶液褪色.
①F的官能团是__.
②C的结构简式是__.
③反应I的化学方程式是__.
(3)下列说法正确的是(选填字母)__.
a.B可使酸性高锰酸钾溶液褪色 b.C不存在醛类同分异构体
c.D的酸性比E弱 d.E的沸点高于对孟烷
(4)G的核磁共振氢谱有3种峰,其峰面积之比为3:2:1.G与NaHCO3反应放出CO2.反应II的化学方程式是__.
(5)芳香族化合物W是C的同分异构体,则W的结构有__种(不含C的结构).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业制取Na2SO3固体的过程如下:

已知:① 反应I在三颈烧瓶中发生,装置如图甲所示(固定及加热类仪器省略)。
② 部分物质的溶解度曲线如图乙所示,其中Na2SO3饱和溶液低于50℃时析出Na2SO3·7H2O。
(l)反应I的目的是制取(NH4)2SO3溶液。

① 反应I的离子方程式为____________。
② 亚硫酸分解产生的SO2须冷却后再通入氨水中,目的是____________。
③ 下列关于图甲装置或操作的叙述正确的是______(填字母)。
A.接入冷凝管的冷却水从a端通入
B.长玻璃导管具有防倒吸的作用
C. 控制加热亚硫酸的温度,可以控制生成SO2气体的速率
(2)为获取更多的Na2SO3固体,要将反应II的温度控制在80℃左右,并_______(填操作I的名称)。
(3)由滤液可以制取NH4Cl固体。
①验证滤液中含有NH4+的实验操作是________。
②由滤液可获得NH4Cl粗产品(含少量Na2SO3)。请补充完整由NH4Cl粗产品制取纯净的NH4Cl固体的实验方案:________,得到纯净的NH4Cl固体。(实验中须使用的试剂有SO2、乙醇,除常用仪器外须使用的仪器有:真空干燥箱)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。
B极区电解液为__________溶液(填化学式),阳极电极反应式为_________________________,
电解过程中Li+向 __________电极迁移(填“A”或“B”)。

(Ⅱ)如图为绿色电源“二甲醚(CH3OCH3)燃料电池”的工作原理示意图.b电极是________极。
请写出负极的电极反应方程式:__________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫酸锰废液(主要含Mn2+、H+、SO42-,还含有少量Cl-、Zn2+、Cu2+)制取金属锰的流程如下:

(1)滤渣I的主要成分是CuCl,潮湿条件下易被空气氧化。过滤I操作时间不宜过长,其原因是_____________(用离子方程式表示)。
(2)若过滤I后所得滤液中Zn2+和Cu2+的浓度均为0.01mol/L,加入(NH4)2S溶液,先析出CuS沉淀,则Ksp(ZnS)_______Ksp(CuS)(填“>”或“<”)。除锌、铜时须控制溶液pH, pH过低,金属离子沉淀不完全,原因是_____________。
(3)写出电解过程中发生反应的化学方程式:_______。若不除去硫酸锰废液中的Cu2+、Zn2+、Cl-,则电解时会导致____________。
(4)向CuCl固体中加入一定量的NaCl溶液,反应过程中各粒子的物质的量随时间变化如图所示。写出该反应过程中的离子方程式:____________(X用对应粒子的化学式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推论正确的是( )
A. SiH4的沸点高于CH4,可推测PH3的沸点高于NH3
B. NH4+为正四面体结构,可推测PH4+也为正四面体结构
C. CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体
D. 金刚石熔化时需要破坏共价键,可推测C60熔化时也破坏共价健
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、
CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
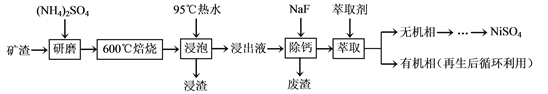
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成
NiSO4、Fe2(SO4)3。
锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是___________________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为____________________。
“浸渣”的成分除Fe2O3、FeO(OH)外还含有________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的_______倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为___________________。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
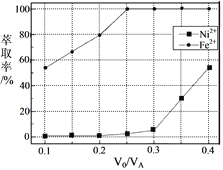
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如下图所示,V0/VA的最佳取值是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了制取并探究氨气性质,按下列装置(部分夹持装置已略去)进行实验。

【实验探究】
(1)实验室制取氨气应选用下图中________发生装置进行实验,反应的化学方程式为
_________________________

(2)B装置中的干燥剂可选用________(填“碱石灰”或“浓硫酸”)。
(3)气体通过C、D装置时,试纸颜色会发生变化的是____(填“C”或“D”)。
(4)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是____________________________________________________________。
(5)F装置中倒置漏斗的作用________________________________________________。
(6)某同学用右图所示装置进行氨气的性质实验,根据烧瓶内产生红色喷泉的现象,说明氨气具有________性质(填序号)。
a.还原性 b.极易溶于水 c.与水反应生成碱性物质
(7)氨气的用途很广。如可用氨气处理二氧化氮:8NH3 + 6NO2 ==7N2 + 12H2O
该反应中氨气体现________(填“氧化性”或“还原性”)。请你列举出氨气的另一种用途_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com