
【题目】 元素性质呈周期性变化的决定因素是( )
A. 元素原子半径呈周期性变化
B. 元素的相对原子质量依次递增
C. 元素原子核外电子排布呈周期性变化
D. 元素的最高正化合价呈周期性变化
科目:高中化学 来源: 题型:
【题目】已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是( )

A. 加入催化剂,减小了反应的热效应
B. 加入催化剂,可提高H2O2的平衡转化率
C. H2O2分解的热化学方程式:2H2O2 = 2H2O + O2 ΔH>0
D. 反应物的总能量高于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

该过程中,请回答以下有关问题:
(1)灼烧海带时,用酒精进行润湿的目的是 。将使用到的硅酸盐质实验仪器有 (填代号)
A试管 B瓷坩埚 C坩埚钳 D铁三角架 E泥三角 F酒精灯 G烧杯
(2)步骤③操作方法的名称为 .
(3)步骤④中发生反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一固定容积的容器中进行反应:SO3(g)+NO(g)![]() NO2 (g)+SO2(g),下列情况一定能说明已经达到化学反应限度的是
NO2 (g)+SO2(g),下列情况一定能说明已经达到化学反应限度的是
A.体系总压强不再随时间而改变 B.体系总质量不再随时间而改变
C.NO(g)和 NO2(g)的生成速率相同 D.SO3 (g)和 NO(g)的浓度比为 1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
___________+___________→___________+___________+___________+H2O
反应物中发生氧化反应的物质是__________,被还原的元素是___________。
反应中1mol氧化剂__________(填“得到”或“失去”)_________mol电子。
II、图中所示工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中的NaCl的质量分数。
![]()
①如何检验氯化钡溶液已过量______________;
检验沉淀是否洗涤干净所用到的试剂是__________;样品中NaCl的质量分数的数学表达式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述Ⅰ和Ⅱ均正确并有因果关系的是
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | 1己醇的沸点比己烷的沸点高 | 1己醇和己烷可通过蒸馏初步分离 |
B | 原电池可将化学能转化为电能 | 原电池需外接电源才能工作 |
C | 乙二酸可与KMnO4溶液发生反应 | 乙二酸具有酸性 |
D | Na在Cl2中燃烧的生成物含离子键 | NaCl固体可导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.强电解质都易溶于水,所以BaSO4是弱电解质
B.一定条件下醋酸溶液的导电能力可能比稀硫酸强
C.SO2的水溶液能导电,所以SO2是电解质
D.金刚石不导电,因此金刚石是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) ![]() Pb(s)+Sn 2+(aq),体系中c(Pb2+)和c(Sn 2+)变化关系如图所示。
Pb(s)+Sn 2+(aq),体系中c(Pb2+)和c(Sn 2+)变化关系如图所示。
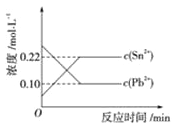
下列判断正确的是( )
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2 固体后,c(Pb2+)变小
C.25 ℃时,该反应的平衡常数K=2.2
D.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为精确测定工业纯碱中碳酸钠的质量分数(含少量NaCl),准确称量W0 g样品进行实验,下列实验方法所对应的实验方案和测量数据最合理(除W0外)的是( )
实验方法 | 实验方案 | 测量数据 | |
A | 滴定法 | 将样品配成100 mL溶液,取10 mL,加入甲基橙, 用标准盐酸滴定 | 消耗盐酸的体积 |
B | 量气法 | 将样品与盐酸反应,生成的气体全部被碱石灰吸收 | 碱石灰增重 |
C | 重量法 | 样品放入烧瓶中,置于天平上,加入足量盐酸 | 减轻的质量 |
D | 量气法 | 将样品与盐酸反应,气体通过排水量气装置量气 | 排水体积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com