
【题目】25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) ![]() Pb(s)+Sn 2+(aq),体系中c(Pb2+)和c(Sn 2+)变化关系如图所示。
Pb(s)+Sn 2+(aq),体系中c(Pb2+)和c(Sn 2+)变化关系如图所示。
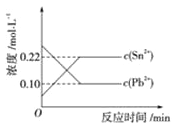
下列判断正确的是( )
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2 固体后,c(Pb2+)变小
C.25 ℃时,该反应的平衡常数K=2.2
D.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
【答案】C
【解析】
试题分析:在含有Pb2+、Sn2+的溶液中,加入过量金属锡(Sn),发生置换反应:Sn(s)+Pb2+(aq)![]() Sn2+(aq)+Pb(s),最终达到平衡。A.往平衡体系中加入金属铅后,由于固体的浓度不变,不能使平衡发生移动,c(Pb2+)不变,A错误;B.往平衡体系中加入少量Sn(NO3)2固体,在酸性条件下,Sn、H+、NO3-、发生氧化还原反应产生Sn2+,使c(Sn2+)增大,增大生成物的浓度,平衡逆向移动,所以c(Pb2+)变大,B错误;C.25℃时,该反应的平衡常数K=
Sn2+(aq)+Pb(s),最终达到平衡。A.往平衡体系中加入金属铅后,由于固体的浓度不变,不能使平衡发生移动,c(Pb2+)不变,A错误;B.往平衡体系中加入少量Sn(NO3)2固体,在酸性条件下,Sn、H+、NO3-、发生氧化还原反应产生Sn2+,使c(Sn2+)增大,增大生成物的浓度,平衡逆向移动,所以c(Pb2+)变大,B错误;C.25℃时,该反应的平衡常数K=![]() =2.2,C正确;D.升高温度,平衡体系中c(Pb2+)增大,说明升高温度,平衡逆向移动。根据平衡移动原理:升高温度,平衡向吸热反应方向移动,逆反应方向是吸热反应,所以该反应的正反应为放热反应,D错误,答案选C。
=2.2,C正确;D.升高温度,平衡体系中c(Pb2+)增大,说明升高温度,平衡逆向移动。根据平衡移动原理:升高温度,平衡向吸热反应方向移动,逆反应方向是吸热反应,所以该反应的正反应为放热反应,D错误,答案选C。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】(10分)常温下向25 mL盐酸中逐滴滴入0.1 mol·L-1氨水,溶液中由水电离出的H+浓度c水(H+)随滴入氨水的体积变化如图所示。

(1)盐酸的浓度为________________;V1的值为________________。
(2)B点和D点溶液中的溶质分别是__________、________________(填化学式)。
(3)在V(NH3·H2O)从0到V2 mL的变化过程中,溶液中不可能出现的离子浓度排序是______(填字母)。
A.c(Cl-)>c(NH)>c(H+)>c(OH-)
B.c(NH)>c(Cl-)>c(H+)>c(OH-)
C.c(NH)>c(Cl-)>c(OH-)>c(H+)
D.c(H+)>c(Cl-)>c(NH)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 元素性质呈周期性变化的决定因素是( )
A. 元素原子半径呈周期性变化
B. 元素的相对原子质量依次递增
C. 元素原子核外电子排布呈周期性变化
D. 元素的最高正化合价呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素X的最高价含氧酸的化学式为HnXO2n-2,则在其气态氢化物中,X元素的化合价为( )
A. 3n-6 B. 5n-12 C. 3n-12 D. n-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c 1、c 2、c 3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1mol·L -1、0.3mol·L -1、0.08mol·L -1,则下列判断不正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c 1、c 2、c 3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1mol·L -1、0.3mol·L -1、0.08mol·L -1,则下列判断不正确的是( )
A.c 1:c 2=1:3
B.平衡时,Y和Z的生成速率之比为2:3
C.X、Y的转化率相等
D.c 1的取值范围为0mol·L -1<c 1<0.14mol·L -1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 石墨烯和石墨互为同素异形体
B. 乙酸和硬脂酸(C17H25COOH)互为同系物
C. 丙烷与氯气反应,可得到沸点不同的3种一氯代物
D. (CH3)3CCH2CH3的名称是2,2-二甲基丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应8NH3+3Cl2=6NH4Cl+N2,下列说法正确的是( )
A. N2是还原产物
B. NH3在反应中得到电子
C. 1molCl2反应转移电子的物质的量为3 mol
D. 该反应中被氧化的物质与被还原的物质物质的量之比为2:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com