
【题目】钼酸钠晶体( Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:

(1) NaClO的电子式是 。
(2)为了提高焙烧效率,除增大空气量外还可以采用的措施是 。
(3)途径I碱浸时发生反应的化学反应方程式为 。
(4)途径Ⅱ氧化时发生反应的离子方程式为 。
(5)分析纯的钼酸钠常用四钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的尾气一起通入水中,得到正盐的化学式是 。
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图:

①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为__ __。
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是 。
③试分析随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是 。
【答案】(1)![]() (2)充分粉碎(或逆流焙烧)(3)MoO3+Na2CO3=Na2MoO4+CO2↑
(2)充分粉碎(或逆流焙烧)(3)MoO3+Na2CO3=Na2MoO4+CO2↑
(4) MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O (5) (NH4)2CO3、(NH4)2SO3
(6) ①1:1 ②常温下浓硫酸具有强氧化性,会使铁钝化
③Cl-有利于碳素钢的腐蚀,SO42-不利于碳素钢的腐蚀
【解析】
试题分析:利用钼精矿制备钼酸钠有两种途径:途径Ⅰ是先在空气中灼烧生成MnO3,同时得到对环境有污染的气体SO2,然后再用纯碱溶液溶解MnO3,即可得到钼酸钠溶液,最后结晶得到钼酸钠晶体;途径Ⅱ是直接用NaClO溶液在碱性条件下氧化钼精矿得到钼酸钠溶液,结晶后得到钼酸钠晶体;
(1)NaClO是离子化合物,电子式为![]() ;
;
(2)提高焙烧效率,除增大空气量外还可以采用的措施是充分粉碎或逆流焙烧;
(3)途径I碱浸时发生反应的化学方程式为MoO3+Na2CO3=Na2MoO4+CO2↑;
(4)途径Ⅱ用NaClO在碱性条件下氧化MoO3,发生反应的离子方程式为MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
(5)CO2和NH3一起通入水中生成的正盐为碳酸铵,化学式为(NH4)2CO3,如果是SO2气体则生成正盐为(NH4)2SO3;
(6)①根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,即浓度比为1:1;
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是常温下浓硫酸具有强氧化性,会使铁钝化,起到防腐蚀作用;
③由图示数据可知,碳钢在盐酸中的腐蚀速率明显快于硫酸的腐蚀速度;硫酸浓度增大变成浓硫酸后,发生了钝化现象,腐蚀速度很慢。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A.PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B.棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O
C.绿色化学要求从源头上消除或减少生产活动对环境的污染
D.压缩天然气和液化石油气是我国已经推广使用的清洁燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂为了综合利用生产过程中的副产品CaSO4,与相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程:

请回答以下问题:
(1)合成氨反应的化学方程式是 ,该反应在 (填设备名)中发生。沉淀池中发生的主要反应方程式是 ,该反应能够发生的原因是 。
(2)在上述流程的沉淀池中通入足量氨气的目的是 ,可以循环使用的X是 。
(3)该生产过程中的副产品是 。从绿色化学和资源综合利用的角度说明上述流程的主要优点是 ;从物质的性质和工业生产实际的角度考虑该流程的主要缺陷是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修5:有机化学基础】芳香化合物A是一种基本化工原料,可以从煤和石油中得到。OPA是一种重要的有机化工中间体.A、B. C. D. E.F和OPA的转化关系如下所示:
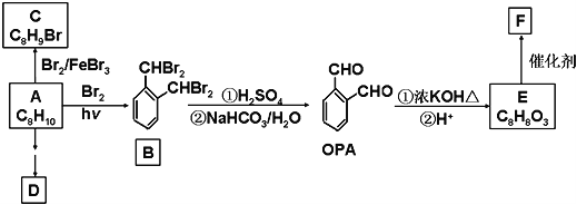
已知:
回答下列问题:
(1)A的化学名称是___;
(2)写出C所有可能的结构简式___;
(3)D(邻苯二甲酸二乙酯)是一种增塑剂。请用A. 不超过两个碳的有机物及合适的无机试剂为原料,经两步反应合成D的路线___;
(4)OPA的化学名称是___,OPA经中间体E可合成一种聚酯类高分子化合物F,该反应的化学方程式为_______;
(5)芳香化合物G是E的同分异构体,G分子中含有醛基、酯基和醚基三种含氧官能团,写出G任意一种可能的结构简式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的框架图,请根据下面提问回答:

(1)在上面元素周期表中全部是金属元素的区域为
(a) A (b) B (c) C (d) D
(2)用物质的名称填写,硬度最大的是单质是 ,密度最小的金属是 ;通常状况呈液态的非金属单质是 ,地壳中含量最多的非金属元素是 。
(3)在原子序数为1~18号元素中,请用化学式填写。与水反应最剧烈的金属元素是 ; 元素的气态氢化物最稳定的物质是 ;元素的最高价氧化物所对应的酸其酸性最强的物质是 ;原子半径最大的金属与原子半径最小的非金属形成的化合物是 ,并用电子式表示其形成过程: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为![]() 计算:
计算:
(1)该条件下N2的平衡转化率;(小数点后保留一位)
(2)该条件下反应2NH3(g)![]() N2(g)+3H2(g)的平衡常数。(不带单位)
N2(g)+3H2(g)的平衡常数。(不带单位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为元素周期表截取的短周期的一部分,即![]() 。四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是
。四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是
A. 原子半径:W>Z>Y>X
B. 气态氢化物的稳定性:Z>W>X>Y
C. W的最高正化合价与负化合价的绝对值可能相等
D. Z的最高价氧化物的水化物可能为强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为__________________________;
(2)A中的碳原子是否都处于同一平面?____________(填“是”或“不是”);
(3)在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体。

(a)反应②的化学方程式为__________________________________________;
(b)C的化学名称是__________________________________________ ;
(c)E2的结构简式是__________________________________________ ;
(d)④、⑥的反应类型依次是______________________ , ____________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F分别代表原子序数依次增大的短周期元素。A和D属同族元素;B和F位于第VIIA族;A和B可形成化合物AB4;C基态原子的s轨道和p轨道的电子总数相等;E的一种单质在空气中能够自燃。 请回答下列问题:
(1)D基态原子的电子排布式是_____________________。
(2)利用价层电子对互斥理论判断EF3的立体构型是______。
(3)A所在周期元素最高价氧化物对应的水化物中,酸性最强的是______(填化学式);B和F的氢化物中沸点较高的是_____(填化学式);C、D、F的单质形成的晶体,熔点由高到低的排列顺序是_______(填化学式)。
(4)CuSO4溶液能用作E4中毒的解毒剂,反应可生成E的最高价含氧酸和铜,该反应的化学方程式是_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com