
 氮及其化合物在工农业生产生活中应用广泛,请解决下列问题.
氮及其化合物在工农业生产生活中应用广泛,请解决下列问题.分析 (1)Cu元素的化合价由+2价降低到+1价,CuSO4是氧化剂,P4中部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,根据电子转移是计算被CuSO4氧化的P4的物质的量;
(2)①2NH3(g)+CO2(g)=NH2CO2NH4(s);△H=-159.47kJ•mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);△H=a kJ•mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);△H=-86.98kJ•mol-1
依据热化学方程式和盖斯定律①+②=③,依据热化学方程式和盖斯定律来计算;
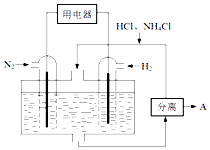
(3)原电池正极发生还原反应,依据装置图分析判断分离出氯化铵;
(4)常温下,向0.1mol/L氨水中加入少许N2O5,五氧化二氮和水反应生成硝酸,硝酸和氨水反应,溶液中c(NH3•H2O):c(NH4+)=5:9,溶液中溶质为硝酸铵和一水合氨,根据NH3•H2O的电离平衡常数计算;
(5)依据所给质量分数求算该酸的化学式,然后书写即可.
解答 解:(1)Cu元素的化合价由+2价降低到+1价,CuSO4是氧化剂,P4中部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,若6molH3PO4生成,则参加反应CuSO4为6mol×$\frac{60}{24}$=15mol,根据电子转移守恒,被CuSO4氧化的P4的物质的量为$\frac{15mol×1}{4×5}$=0.75mol,
故答案为:0.75mol;
(2)①2NH3(g)+CO2(g)=NH2CO2NH4(s);△H=-159.47kJ•mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);△H=a kJ•mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);△H=-86.98kJ•mol-1
依据热化学方程式和盖斯定律①+②=③,得到-159.47KJ/mol+a=-86.98KJ/mol
a=+72.49KJ/mol;
故答案为:+72.49;
(3)以N2、H2为原料,以HCl-NH4Cl为电解质溶液构成新型燃料电池,正极发生还原反应,即氮气被还原生成NH4+,电极反应式为N2+6e-+8H+=2NH4+;负极是氢气失电子生成氢离子,政绩生成铵根离子在电解质溶液中可以分离出氯化铵;
故答案为:N2+6e-+8H+=2NH4+; NH4Cl;
(4)常温下,向0.1mol/L氨水中加入少许N2O5,五氧化二氮和0.1水反应生成硝酸,硝酸和氨水反应,溶液中c(NH3•H2O):c(NH4+)=5:9,溶液中溶质为硝酸铵和一水合氨,NH3•H2O?NH4++OH-,25℃时.NH3•H2O的电离平衡常数Kb=1.8×10-5=$\frac{c(O{H}^{-})×\frac{9}{14}×0.1}{\frac{5}{14}×0.1}$,c(OH-)=10-5mol/L,c(H+)=10-9mol/L,PH=9,
故答案为:9;
(5)SiO2溶于氢氟酸后生成一种极强的二元酸和水,该酸由3种元素组成,其中氟元素的质量分数为79.17%,分子中H原子数目为2,令该酸的化学式为:H2SixFy,根据化合价代数和为0可知2+4x-y=0,由氟元素质量分数有$\frac{19y}{2+28x+19y}$×100%=79.17%,联立解得x=1,y=6,故该酸为H2SiF6,故SiO2溶于氢氟酸的离子反应方程式为:SiO2+6HF=2H++SiF62-+2H2O,故答案为:SiO2+6HF=2H++SiF62-+2H2O.
点评 本题考查热化学方程式书写方法和盖斯定律计算应用,图象分析和反应条件判断,信息应用能力,原电池电极反应书写的方法应用,题目难度较大.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:解答题
| n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
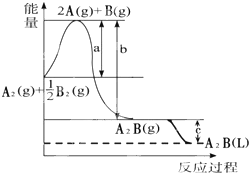 已知:A2(g)+$\frac{1}{2}$B2(g)═A2B(g),反应过程中能量变化如图,问:
已知:A2(g)+$\frac{1}{2}$B2(g)═A2B(g),反应过程中能量变化如图,问:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
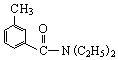 ; DEET在一定条件下,可通过下面的路线来合成:
; DEET在一定条件下,可通过下面的路线来合成: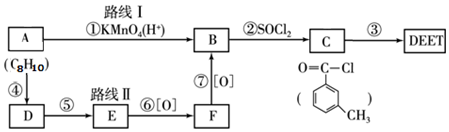
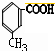 .
.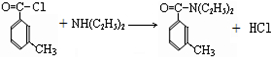 .
.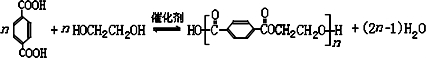 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞溶液.检验其中OH-的实验方法省略,检验其他阴离子的过程如图所示.
某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞溶液.检验其中OH-的实验方法省略,检验其他阴离子的过程如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
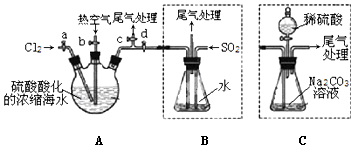
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
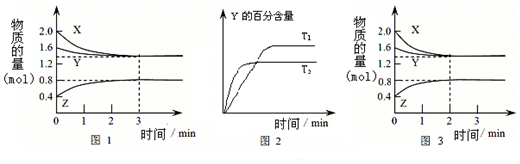
| A. | 容器中发生的反应可表示为:2X(g)+Y(g)?2Z(g) | |
| B. | 0~3 min内,v(X)=0.2 mol•L-1•min-1 | |
| C. | 其他条件不变升高温度,v正、v逆都增大,且重新平衡前v正>v逆 | |
| D. | 若改变条件,使反应进程如图3所示,则改变的条件可能是增大压强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com