
分析 (1)依据阿伏伽德罗定律可知:同温同压下,同体积任何气体具有相同的物质的量,结合m=nM计算;
(2)依据N=nNA结合1个氨气分子和1个水分子都含有10个质子解答;
(3)硫酸铝为强电解质完全电离,1mol硫酸铝电离产生3mol硫酸根离子和2mol铝离子;
(4)依据n=$\frac{N}{{N}_{A}}$=$\frac{V}{Vm}$解答;
(5)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据溶液稀释过程中所含溶质的物质的量不变计算需要浓硫酸的体积.
解答 解:(1)依据阿伏伽德罗定律可知:同温同压下,同体积任何气体具有相同的物质的量,所以同温同压下,同体积的NH3和H2O(水蒸气)物质的量之比为1:1,质量之比:1×17:1×18=17:18;
故答案为:17:18;
(2)0.3mol NH3分子中所含质子数为0.3NA,1个氨气分子和1个水分子都含有10个质子,所以0.3NA 个H2O分子中所含质子数相等;
故答案为:0.3NA;
(3)硫酸铝为强电解质完全电离,1mol硫酸铝电离产生3mol硫酸根离子和2mol铝离子,设硫酸铝的物质的量为x,则x×2=0.4mol,x=0.2mol,含有硫酸根离子物质的量为0.2mol×3=0.6mol;
故答案为:0.6mol;
(4)依据n=$\frac{N}{{N}_{A}}$可知分子数与物质的量成正比,所以2molSO3和3molSO2其分子数之比为2:3;
依据n=$\frac{V}{Vm}$可知,相同状况下,n与V成正比,所以2molSO3和3molSO2其体积之比为2:3;
故答案为:2:3 2:3;
(5)98%的浓硫酸(ρ=1.84g/cm3 )物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸的体积为V,依据溶液稀释过程中所含溶质的物质的量不变得:18.4mol/L×V=0.5mol/L×500mL,解得V=13.6mL;
故答案为:13.6.
点评 本题考查了阿伏伽德罗常数的综合应用,熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间关系是解题关键,题目难度不大.


科目:高中化学 来源: 题型:实验题

| 名称 | 相对分 子质量 | 性状 | 密度(g/mL) | 沸点(℃) | 溶解性 | |
| 苯胺 | 93 | 无色油状液体 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚 |
| 乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
| 乙酰 苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,可溶于热水 | 易溶于乙醇、乙醚 |
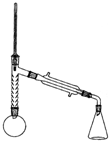
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解NaH2PO2溶液,其阴极反应式为:2H2O-4e-═O2↑+4H+ | |
| B. | H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-═PO23-+3H2O | |
| C. | 将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的还原产物可能为H3PO4 | |
| D. | H3PO2溶于水的电离方程式为H3PO2?H++H2PO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
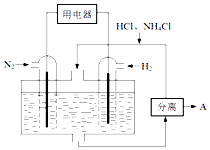 氮及其化合物在工农业生产生活中应用广泛,请解决下列问题.
氮及其化合物在工农业生产生活中应用广泛,请解决下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{ω}{5}$ g•mol-1 | B. | 2ωg | C. | 2ω g•mol-1 | D. | 4ω g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
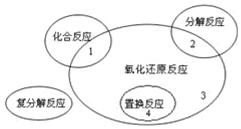
| A. | AgNO3+NaCl═AgCl↓+NaNO3 | B. | 2F2+2H2O═4HF+O2 | ||
| C. | MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑ | D. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C的生成速率与C的分解速率相等 | |
| B. | 单位时间内amol A生成,同时生成3amol B | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体的平均相对分子质量不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com