
����Ŀ����ͼ��Zn��Cu�γɵ�ԭ��أ�ijʵ����ȤС������ʵ����ڶ��鿨Ƭ�ϼ�¼���£��ڿ�Ƭ�ϣ������������ǣ� ��
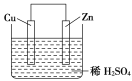
��Zn������Cu����
��H+�������ƶ�
��������������Zn�����·����Cu
��Cu������H2����
������1mol�����������ߣ������H2Ϊ0.5mol
�������ĵ缫��ӦʽΪ��Zn��2e-=Zn2+
A.�٢ڢۢ�B.�ڢۢܢ�C.�ڢܢݢ�D.�٢ڢۢ�
���𰸡�B
��������
����ͼʾ����Zn��Cu�γɵ�ԭ��أ�ԭ����л��õ缫����������Zn���������缫��ӦΪ��Zn��2e-=Zn2+��Cu���������缫��ӦΪ��2H++2e��=H2�����ݴ˷������
��һ������£�ԭ����л��ý�������������Zn���������ʢٴ���
��ԭ����У��������������ƶ�����H+�������ƶ����ʢ���ȷ
��ԭ����У����Ӿ����·�ɸ�������������������ԭ�����Zn��������ͭ������������Ӵ�Zn�����·����Cu���ʢ���ȷ��
��H+�������ƶ����������ϵõ����ӱ�Ϊ��������Cu�缫�Ϸ���2H++2e��=H2�����ʢ���ȷ��
����������Ӧ��2H++2e��=H2����֪����1mol���������ߣ����������0.5mol���ʢ���ȷ��
���ݷ����������ĵ缫��ӦʽΪ��2H++2e��=H2���������缫��ӦΪ��Zn��2e-=Zn2+���ʢ���
����������ȷ�����ڢۢܢ�����ѡB��


 ��ѧȫ��������ѵ��ϵ�д�
��ѧȫ��������ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
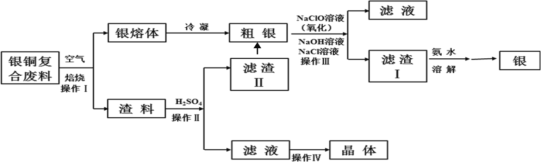
����Ŀ��ij����С���о���ͭ���Ϸ��ϣ������ڣ�����Ag2S�����������ʼ��Ʊ�����ͭ���壬�������£��������е��������������ϵͣ���ʵ��Ӱ��ɺ��ԣ�
��֪����AgCl�����ڰ�ˮ������[Ag(NH3)2]+��
��Ksp��Ag2SO4��=1.2��105��Ksp��AgCl��=1.8��1010��
�������к��������������������ܣ���
��1������I��Ϊ�˼ӿ�����������ʣ����Բ�ȡ_______��ʩ(д������һ�ּ���)��
��2������IV����________��_______���ˡ�ϴ�Ӻ�����Եõ�����ͭ���塣
��3��ϴ������II��������ϲ���Ŀ����__________��
��4������III�У�NaClO��Һ��Ag��Ӧ�IJ���ΪAgCl��NaOH��NaCl��O2���÷�Ӧ�Ļ�ѧ����ʽΪ______������AgCl��NaCl�����ʵ���֮��Ϊ2��1����������ͬʱ��������ת�������ӷ���ʽΪ_____����ƽ�ⳣ��K=__________��
��5���ڿ����м���5.20g����ͭ����(CuSO4��5H2O)��Ʒ�����ȹ����в�ͬ�¶ȷ�Χ�ڷֱ�õ�һ�ֹ������ʣ����������������֪CuSO4��5H2O��Է�������250��
�¶ȷ�Χ/�� | ��������/g |
200~260 | 3.33 |
650~800 | 1.67 |
1000~1500 | 1.50 |
���ȵ�1000��ʱ���������ʵĻ�ѧʽΪ��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2-��ϩ��ʯ���ѽ�IJ���֮һ���ش��������⣺
��1���ڴ��������£�2-��ϩ��������Ӧ�Ļ�ѧ����ʽΪ____________����Ӧ����Ϊ______��
��2��ϩ��A��2-��ϩ��һ��ͬ���칹�壬���ڴ�����������������Ӧ�IJ��ﲻ�������飬��A�Ľṹ��ʽΪ_________��A�������ܹ���ƽ���̼ԭ�Ӹ���Ϊ________��A��������Ȼ�̼��Һ��Ӧ�Ļ�ѧ����ʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.2mol MnO2��50mL 12mol��L-1�����Ϻ������ȣ���Ӧ��ȫ�������µ���Һ�м�������AgNO3��Һ������AgCl���������ʵ���Ϊx mol������������Ļӷ�������x��ȡֵ��Χ��
A.x��0.3B.x��0.3C.0.3��x��0.6D.���Ͻ��۶�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л������������˵������ȷ����
A. ��������A��B�������ֱ���ȫȼ�պ����ɵ�CO2�����ĵ�O2�����ʵ�������ͬ����A��Bһ����Ϊͬϵ��
B. �е�Ƚϣ�������>������>������
C. �������Ҵ���һ�������·�Ӧ��������������ˮ�ķ�Ӧ����ȡ����Ӧ
D. �жϱ������в�����̼̼������̼̼˫���Ľ���ṹ�������ǣ��ڶ��ױ�ֻ��һ�ֽṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ���ͭ��CuCl��������ˮ���������������������ռ������ȼ��ȡ�
��1����һ��������CuSO4��NaCl��Һ�г�������һ��Ũ�ȵ�Na2SO3��Һ���Ƶ�CuCl�������Na2SO3��Һ�������ҺpH��ϵ��ͼ��ʾ��

�� 0 ~ 600 mLʱpH���͵�ԭ����_______�������ӷ���ʽ��ʾ����
�� 600 ~ 2000 mL�Ĺ������д̼�����ζ�������������������__________��
��2��CuCl����һ���Ʊ�ԭ����Cu2++Cu+2Cl����2CuCl K��5.85��106����0.01 molL��1��CuCl2��Һ�м���������ͭ��д���������˵���ܷ�����CuCl�� ________��
��3��ʹ��CuCl��CO����ķ�ӦΪCuCl(s) + xCO(g) ![]() CuClxCO(s) ��H < 0��Ϊ���CO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��____�����ţ���
CuClxCO(s) ��H < 0��Ϊ���CO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��____�����ţ���
A�������¶� B������ѹǿ
C���ӳ���Ӧʱ�� D����CuCl��ɢ�����ɶ�ķ���ɸ��
���Ƽ��仯������й㷺����;��
��1�������£�Ũ�Ⱦ�Ϊ0.1mol/L����������������Һ��pH���±�:
���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
��������Һ�е������ӣ����������������ǿ����__________ �����ݱ������ݣ��������������Һ�ֱ�ϡ��100����pH�仯�����ǣ�����ţ�___________
A�� HClO B��H2CO3 C�� CH3COOH
��2������������һ�� ______������ǿ����������������ʡ�ijС��ͬѧ̽������NaClO��KAl(SO4)2��Һ��Ϸ�Ӧ��ʵ�顣��������ƿ�е�NaClO���뱥��KAl(SO4)2��Һ�����������İ�ɫ��״�������������������ԭ����______�����÷�Ӧ�����ӷ���ʽ��ʾ����
��3��ʵ�����г�����������������ϴ�����ᴿ��
��150mL 1mol/L������������Һ���ձ����2.24L������̼ʱ��������Һ�и�����Ũ���ɴ�С��˳��Ϊ��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ѧ��β����ͨ��ģ�����ɢ���ľۼ���Ϣ�ؿɸ�Ч�ղ����棬����һ�����T��ͨ�����з�Ӧ·�ߺϳ�(���ַ�Ӧ������)��
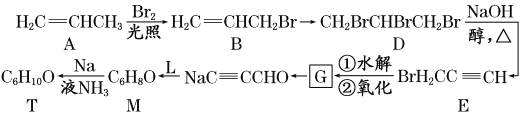
(1)A�Ļ�ѧ������______��A��B�����ɵĹ�����������______
(2)D�ĺ˴Ź���������ʾ�������Ϊ________
(3)A��B�Ļ�ѧ����ʽΪ_______
(4)D��E�Ļ�ѧ����ʽΪ_______
(5)G�����Ƶ�Cu(OH)2������Ӧ�������л���Ľṹ��ʽΪ____
(6)L����B��H2�����ӳɷ�Ӧ���ã���֪:R1CH2Br+![]() +NaBr����M�Ľṹ��ʽΪ___________
+NaBr����M�Ľṹ��ʽΪ___________
(7)��֪��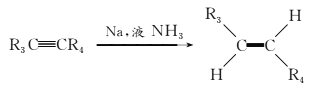
��T�Ľṹ��ʽΪ____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ���������ֵ������˵���������( )
A.��״���£�11.2L���麬��ԭ����ĿΪ2NA
B.100g 46�����Ҵ���Һ�У�����ԭ�ӵ���ĿΪNA
C.14 g��ϩ�ͱ�ϩ��������е���ԭ����Ϊ2NA
D.48 g�������10 g�춡��Ļ�����й��ۼ���ĿΪ13NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Һ��ȼ�ϵ�����������ȼ�ϵ�ؾ������С���ŵ㣮һ����Һ̬�£�N2H4��Ϊȼ�ϵĵ��װ����ͼ��ʾ���õ���ÿ����е�������Ϊ��������KOH��Һ��Ϊ�������Һ�����ڸõ�ص�������ȷ���ǣ�������

A. b������������Ӧ
B. a��Ϊ�õ�ص�����
C. �ŵ�ʱ��������a��������������b��
D. a���ķ�Ӧʽ��N2H4+4OH����4e���TN2��+4H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com