
����Ŀ�����Ȼ���ͭ��CuCl��������ˮ���������������������ռ������ȼ��ȡ�
��1����һ��������CuSO4��NaCl��Һ�г�������һ��Ũ�ȵ�Na2SO3��Һ���Ƶ�CuCl�������Na2SO3��Һ�������ҺpH��ϵ��ͼ��ʾ��

�� 0 ~ 600 mLʱpH���͵�ԭ����_______�������ӷ���ʽ��ʾ����
�� 600 ~ 2000 mL�Ĺ������д̼�����ζ�������������������__________��
��2��CuCl����һ���Ʊ�ԭ����Cu2++Cu+2Cl����2CuCl K��5.85��106����0.01 molL��1��CuCl2��Һ�м���������ͭ��д���������˵���ܷ�����CuCl�� ________��
��3��ʹ��CuCl��CO����ķ�ӦΪCuCl(s) + xCO(g) ![]() CuClxCO(s) ��H < 0��Ϊ���CO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��____�����ţ���
CuClxCO(s) ��H < 0��Ϊ���CO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��____�����ţ���
A�������¶� B������ѹǿ
C���ӳ���Ӧʱ�� D����CuCl��ɢ�����ɶ�ķ���ɸ��
���Ƽ��仯������й㷺����;��
��1�������£�Ũ�Ⱦ�Ϊ0.1mol/L����������������Һ��pH���±�:
���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
��������Һ�е������ӣ����������������ǿ����__________ �����ݱ������ݣ��������������Һ�ֱ�ϡ��100����pH�仯�����ǣ�����ţ�___________
A�� HClO B��H2CO3 C�� CH3COOH
��2������������һ�� ______������ǿ����������������ʡ�ijС��ͬѧ̽������NaClO��KAl(SO4)2��Һ��Ϸ�Ӧ��ʵ�顣��������ƿ�е�NaClO���뱥��KAl(SO4)2��Һ�����������İ�ɫ��״�������������������ԭ����______�����÷�Ӧ�����ӷ���ʽ��ʾ����
��3��ʵ�����г�����������������ϴ�����ᴿ��
��150mL 1mol/L������������Һ���ձ����2.24L������̼ʱ��������Һ�и�����Ũ���ɴ�С��˳��Ϊ��_________��
���𰸡�2Cu2+ + 2Cl- + SO32- + H2O = 2CuCl��+ SO42- +2H+ SO2 �� ����ΪQc= 1/(0.01 x 0.022)= 2.5x105 �� K������������CuCl AB CO32- C ǿ 3ClO�D + Al3+ + 3H2O![]() 3HClO + Al (OH)3�� c��Na������c��HCO3-����c��CO32-����c��OH-����c��H����
3HClO + Al (OH)3�� c��Na������c��HCO3-����c��CO32-����c��OH-����c��H����
��������
��1����CuSO4��NaCl��Һ�г�������һ��Ũ�ȵ�Na2SO3��Һ���Ƶ�CuCl��������������ԭ��Ӧ�����ӷ���ʽΪ��2Cu2++2Cl��+SO32��+H2O=2CuCl��+SO42��+2H+���淴Ӧ���У�������Ũ������pH��С��
�ڼ�����������������Һ�����������ӣ�����SO2���壬pHֵ����
��2����0.01 molL��1��CuCl2��Һ�м���������ͭ����Qc=1/[c(Cu2+)c2(Cl��)]= ![]() =2.5��105<K����Ӧ������У�������CuCl��
=2.5��105<K����Ӧ������У�������CuCl��
��3��������Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���CO��ƽ��ת��������A��ȷ������ѹǿ��ƽ���������ƶ���CO��ƽ��ת��������B��ȷ���ﵽƽ����ӳ���Ӧʱ�䣬���ܸı�CO��ƽ��ת���ʣ�C����CuCl��ɢ�����ɶ�ķ���ɸ�У�����Ӧ���ʣ���Ӱ��CO��ƽ��ת���ʣ�D����
��ѡAB��
��1��Խ����ˮ����Σ�Խ����������ӣ���ͬŨ�ȵ�������Һ��pHԽ�����ε�ˮ��̶�Խ������������ˮ�������̼���ƣ�����������������ӵ�������ΪCO32- �����������жϣ����ԣ�CH3COOH>H2CO3>HClO��Ũ����ͬ����ϡ����ͬ����������Խǿ����pH�仯Խ��������ҺpH�仯����ΪCH3COOH��
��ѡC��
��2���������������Σ���һ��ǿ����ʣ���ƿ�м��뱥��KAl(SO4)2��Һ�������������ˮ����Һ�Լ��ԣ�������ˮ����Һ�����ԣ���Ϻ�ˮ����ٽ�3ClO�D + Al3+ + 3H2O![]() 3HClO + Al (OH)3�������������İ�ɫ��״�����ʹ����
3HClO + Al (OH)3�������������İ�ɫ��״�����ʹ����
��3��0.15 mol��1mol/L��0.15L=0.15mol���������ƺ�0.1 mol��2.24L��22.4L/mol=0.1mol��������̼��Ӧ�������ʵ�����Ϊ0.05mol��̼�����ƺ�̼���ƣ�����̼����ĵ�һ��ˮ��̶ȴ��ڵڶ���ˮ��̶ȣ�����̼���������Ũ�ȴ���̼�������Ũ�ȣ���Һ�Լ��ԣ�����Ũ�ȹ�ϵΪc��Na������c��HCO3-����c��CO32-����c��OH-����c��H������


 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⺣����һ�ַ�������X-CT��Ӱ�����������Ի�����A(����ʽΪC8H10�ı���ͬϵ��)Ϊԭ�Ϻϳɵ⺣���ĺϳ�·��[RΪ-CH2CH(OH)CH2OH]��
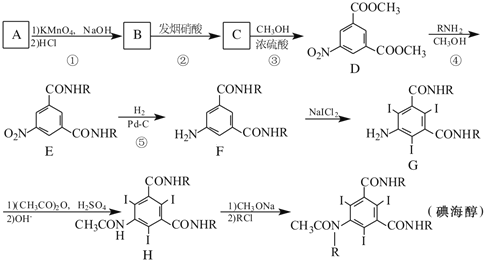
��1��д��A�Ľṹ��ʽ��____________��
��2����Ӧ��-���У�����ȡ����Ӧ����____________(�����)��
��3��д��C�к��������ŵ����ƣ�������____________��
��4��д��ͬʱ��������������D������ͬ���칹��Ľṹ��ʽ��____________��
������1������̼ԭ�ӵ���-������
������������3��ȡ��������������6�ֲ�ͬ��ѧ��������
�����ܷ���������Ӧ��ˮ�����֮һ����FeCl3��Һ������ɫ��Ӧ
��5����֪����![]()
��![]() �������ԣ��ױ�����
�������ԣ��ױ�����
��д����![]() ��(CH3CO)2OΪԭ���Ʊ�Ⱦ���м���
��(CH3CO)2OΪԭ���Ʊ�Ⱦ���м���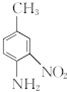 �ĺϳ�·������ͼ(���Լ�����)____________________���ϳ�·������ͼʾ�����£�
�ĺϳ�·������ͼ(���Լ�����)____________________���ϳ�·������ͼʾ�����£�![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������H��������·�ߺϳɣ�
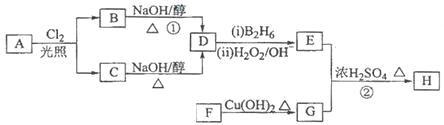
��֪��![]()
��ش��������⣺
��1����״����11.2L��A�������г��ȼ�տ�������88gCO2��45gH2O����A���ӽṹ����3��������A�Ľṹ��ʽΪ________________________��
��2��B��C��Ϊһ�ȴ�����D�����ƣ�ϵͳ������Ϊ_________________��
��3���ڴ���������1molF��2molH2��Ӧ������3��������1��������F�Ľṹ��ʽ��___________��
��4����Ӧ���ķ�Ӧ������_______________________��
��5����Ӧ���Ļ�ѧ����ʽΪ______________________________________��
��6��д��������G������ͬ�����ŵķ�����ͬ���칹��Ľṹ��ʽ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ijԪ�صļ����άͼ������AΪ���Σ�X��һ��ǿ�ͨ��������Z����ɫҺ�壬E����Է���������D��16�������ʵ�ת����ϵ��ͼ��ʾ������˵���������
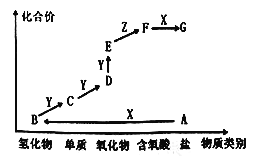
A. A������ʱ���ʺ����ľ�һ��ʩ��
B. ͬ����Ԫ�ص��⻯����B�ķе����
C. Cһ������ˮ���ռ�
D. D��E�ķ�Ӧ�����ڼ���D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Zn��Cu�γɵ�ԭ��أ�ijʵ����ȤС������ʵ����ڶ��鿨Ƭ�ϼ�¼���£��ڿ�Ƭ�ϣ������������ǣ� ��
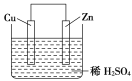
��Zn������Cu����
��H+�������ƶ�
��������������Zn�����·����Cu
��Cu������H2����
������1mol�����������ߣ������H2Ϊ0.5mol
�������ĵ缫��ӦʽΪ��Zn��2e-=Zn2+
A.�٢ڢۢ�B.�ڢۢܢ�C.�ڢܢݢ�D.�٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п����ȼ�ϵ�ؿ������綯��������Դ����صĵ������ҺΪKOH��Һ����ӦΪ2Zn+O2+4OH�C+2H2O=2![]() ������˵����ȷ����( )
������˵����ȷ����( )
A.�ŵ�ʱ���������Һ��K+���ƶ�
B.�ŵ�ʱ���������Һ��c(OH-)������
C.�ŵ�ʱ��������ӦΪ��Zn+4OH--2e-=![]()
D.�ŵ�ʱ����·��ͨ��2mol���ӣ���������22.4L(��״��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����18�֣��ӱ������еõ�һ����A��C10H16��������������������A��ط�Ӧ���£�
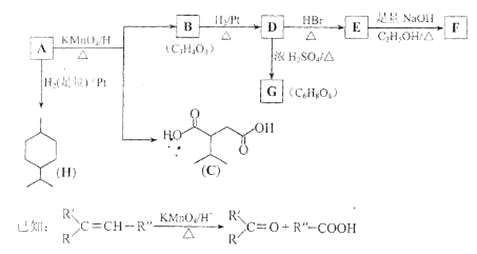
��1��H�ķ���ʽΪ ��
��2��B���������ŵ�����Ϊ ��
��3����������COOCH3���ŵ�C��ͬ���칹�干�� �֣������������칹�������к˴Ź������׳���2�����շ���칹��ṹ��ʽΪ ��
��4��B��D��D��E�ķ�Ӧ���ͷֱ�Ϊ �� ��
��5��GΪ����Ԫ���Ļ����д����ṹ��ʽ�� ��
��6��F��һ�������·����ۺϷ�Ӧ�ɵõ�һ�ָ���ˮ����֬������֬����Ϊ ��
��7��д��E��F�Ļ�ѧ����ʽ�� ��
��8��A�Ľṹ��ʽΪ ��A������ʵ�����Br2���мӳɷ�Ӧ�IJ��ﹲ�� �֣������������칹����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ת��;����ijЩ��Ӧ�����Ͳ�����ʡ�ԡ������й�˵������ȷ����
;���� S![]() H2SO4
H2SO4
;���� S![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
A. ;������Ӧ��������Ũ�����ǿ�����Ժ�����
B. ;�����ĵڶ�����Ӧ��ʵ�������п���ͨ������O2Ũ�������ͳɱ�
C. ��;���������ֱ���ȡ1 mol H2SO4�������ϸ�����1 mol S����ת��6 mol e-
D. ;������;������ȸ�����������ɫ��ѧ������������Ϊ;������;������Ⱦ���С��ԭ�������ʸ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10 L�����ܱ������г���X(g)��Y(g)��������ӦX(g)��Y(g) ![]() M(g)��N(g)������ʵ���������±���
M(g)��N(g)������ʵ���������±���
ʵ�� ��� | �¶�/�� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | ||
n(X) | n(Y) | n(M) | |||
�� | 700 | 0.40 | 0.10 | 0.090 | |
�� | 800 | 0.10 | 0.40 | 0.080 | |
�� | 800 | 0.20 | 0.30 | a | |
�� | 900 | 0.10 | 0.15 | b | |
����˵����ȷ����(����)
A. ʵ�����У���5 minʱ���n(M)��0.050 mol����0��5 minʱ���ڣ���N��ʾ��ƽ����Ӧ����v(N)��1.0��10��2 mol��L��1��min��1
B. ʵ�����У��÷�Ӧ��ƽ�ⳣ��K��2.0
C. ʵ�����У��ﵽƽ��ʱ��X��ת����Ϊ60%
D. ʵ�����У��ﵽƽ��ʱ��b>0.060
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com