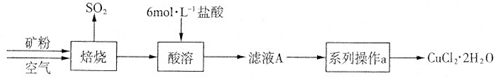
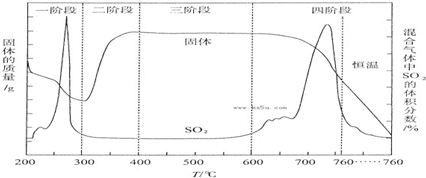
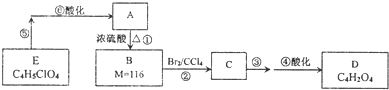
I.用中和滴定法测定某烧碱样品的纯度.(锥形瓶中装待测液)
配制待测液:将2.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制200mL溶液.
(1)滴定:盛装0.20mol/L盐酸标准液应该用酸式滴定管;滴定时,先向盛待测液的锥形瓶中加酚酞作为指示剂;滴定终点的现象是:
(2)有关数据记录如下:
| 滴定序号 | 待测液体积(ml) | 所消耗盐酸标准液的体积(ml) |
| 滴定前 | 滴定后 |
| 1 | 20.00 | 0.50 | 20.55 |
| 2 | 20.00 | 6.00 | 25.95 |
纯度计算:烧碱样品的纯度为
.
(3)对几种假定情况的讨论:(填无影响、偏高、偏低)(测定的结果指烧碱样品的纯度)
①若用蒸馏水冲洗锥形瓶,则会使测定的结果
②若滴定前用蒸馏水冲洗酸式滴定管后即装标准盐酸,则会使测定结果
③滴加盐酸时未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果
.
Ⅱ.现有室温下浓度均为1×10
-3mol/L的几种溶液:①盐酸、②硫酸、③醋酸、④NaOH溶液,回答下列问题:
(1)将③、④混合后,若溶液呈中性,则消耗两溶液的体积为③
④(填“>”、“<”或“=”).溶液中的离子浓度由大到小的顺序为
.
(2)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为
,最终产生H
2总量的关系为
(3)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH
3COONa溶液,充分混合后,混合液的pH大小关系为①
③(填“>”、“<”或“=”)



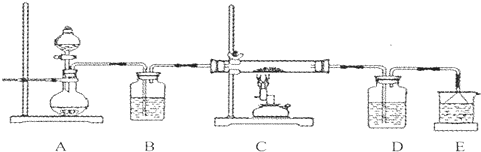
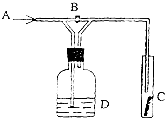 如图是一种试验某种气体化学性质的实验装置,图中B为开关.如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去.则D瓶盛的溶液是( )
如图是一种试验某种气体化学性质的实验装置,图中B为开关.如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去.则D瓶盛的溶液是( )