
【题目】在温度不变、恒容的容器中进行反应2HI![]() H2+I2(正反应为吸热反应),反应物的浓度由0.1 mol/L降到0.06 mol/L,需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为( )
H2+I2(正反应为吸热反应),反应物的浓度由0.1 mol/L降到0.06 mol/L,需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为( )
A.等于10 sB.等于12 sC.大于12 sD.小于12 s
科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。回答下列问题:
(1)基态Fe3+的电子排布式为________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
(3)FeCl3的熔点为306℃,沸点为315℃ FeCl3的晶体类型是______。FeSO4常作补铁剂,SO42-的立体构型是_______。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等,1 mol Fe(CO)5分子中含σ键数目为_______,与CO互为等电子体的离子是__________(填化学式,写一种)
(5)氮化铁晶体的晶体结构示意图如图所示。该晶体中铁、氮的微粒个数之比为______。
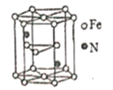
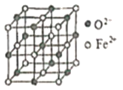
(6)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg·cm-1,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-的最短间距为_______ pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应,X2++Z=X+Z2+,Y+Z2+=Y2++Z。这四种离子被还原成0价时,表现的氧化性强弱顺序为( )
A.R2+>X2+>Z2+>Y2+B.X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+D.Z2+>X2+>R2+>Y2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,全国的雾霾天气对环境造成了严重影响,芜湖市开展了和臭氧的监测。 下列有关说法正确的是
A. 臭氧的摩尔质量是 48g
B. 同温同压条件下,等质量的氧气和臭氧体积比为 2:3
C. 20g 氖气中含有个 6.02 × 1023 个原子
D. 1.00mol 臭氧中含有电子总数为 18 × 6.02 × 1023个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列设计的实验方案能达到相应实验目的的是( )
选项 | 实验目的 | 实验方案 |
A | 探究化学反应的限度 | 取5mL 0.1mol/L KI溶液,滴加0.1mol/L FeCl3溶液5~6滴,充分反应,可根据溶液中既含I2又含I-的实验事实判断该反应是可逆反应 |
B | 探究浓度对化学反应速率的影响 | 用两支试管各取5mL 0.1mol/L的KMnO4溶液,分别加入2mL 0.1mol/L和 0.2mol/L的H2C2O4(草酸 |
C | 证明乙醇的消去反应有乙烯生成 | 将含有浓硫酸的乙醇溶液迅速升温至170℃,将产生的气体直接通入酸性KMnO4溶液中 |
D | 验证醋酸钠溶液中存在水解平衡 | 取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成气态分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期元素中原子半径最大的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子。则
(1)X的化学名称为__________。
(2)B单质的结构式为__________;E的气态氢化物的电子式为__________;C与D形成的两种化合物中,其中一种物质含有两种类型的化学键,分别为______________,该物质属于______________(填“离子化合物”或“共价化合物”)。
(3)B、C、E分别与A形成的化合物中最稳定的是__________(写化学式)。
(4)D是同周期简单阳离子中离子半径最__________(填“大”或“小”)的元素。
(5)F的单质在反应中常作________剂(填“氧化”或“还原”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A(g)+B(g) ![]() 2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
(1)比较a___b(填“>”“=”或“<”)。
(2)下表为不同温度下该反应的平衡常数。由此可推知,表中T1____T2(填“>” “=”或“<”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2molC,500℃时充分反应达平衡后,吸收热量为c kJ,C的浓度___(填“>”、“=”或“<”)ωmol/L,a、b、c之间满足何种关系_______(用代数式表示)。
(3)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是_____。
A.4molA和2molB B.4molA、2molB和2molC C.4molA和4molB D.6molA和4molB
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是____。
A.及时分离出C气体 B.适当升高温度 C.增大B的浓度 D.选择高效催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA和1molB,500℃时充分反应达平衡后,放出热量为d kJ,则d_____b(填“>”“=”或“<”),理由是_________。
(6)在一定温度下,向一个容积可变的容器中,加入3molA和2molB及固体催化剂,使之反应:2A(g)+B(g)![]() 2C(g),平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量_____(填“不变”“变大”“变小”或“无法确定”)。
2C(g),平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量_____(填“不变”“变大”“变小”或“无法确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ⅰ.断裂1molN-N键吸收167kJ热量,形成1molN≡N键放出942kJ热量,Ⅱ.N2(g)+3H2(g)![]() 2NH3(g);△H1=-92.2kJmol-1对于反应:N4(g)+6H2(g)
2NH3(g);△H1=-92.2kJmol-1对于反应:N4(g)+6H2(g)![]() 4NH3(g);△H2(kJmol-1),以下说法正确的是( )
4NH3(g);△H2(kJmol-1),以下说法正确的是( )
A.该反应的反应热△H2>0B.N2分子比N4分子更稳定
C.△H2=2△H1D.△H2与方程式系数无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气有下列反应:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O
(1)该反应中氧化剂是_____;被还原的元素是_______;氧化产物是 ______;
(2)用单线桥法标出电子转移的方向和数目______________;
(3)若该反应中有0.2mol的电子转移,则能生成标准状况下的氯气的体积是_______;
(4)若该反应有1molKMnO4参加反应,被氧化的HCl为______mol,转移电子数______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com