
【题目】I碘是人类发现的第二个生命科学必需微量元素。回答下列问题:
(1)碘在元素周期表的位置为______________;HF的沸点比HI_________(填“高”或“低”)。原因是_____________________________
(2)自然界中的碘有的以NaIO3形态存在于硝石(NaNO3)中,向硝石母液中加入NaHSO3可以制得I2,请写出NaIO3溶液和NaHSO3溶液反应的离子方程式___________________。
II:2019年有科学家发表在《自然》科学杂志上的研究认为:细菌和灵长类动物铁元素争夺战是物种存活的一个决定性因素。请结合你所学的知识回答下列问题:
(1)铁(26号元素)的原子结构示意图为_______________________
(2)写出氢氧化亚铁接触空气变色过程中发生的化学方程式_________________________
(3)Na2FeO4是新型水处理剂,简述其在水处理中的作用和原因_______________________
【答案】第五周期 Ⅶ A族 高 HF分子间能形成氢键 2IO3-+5HSO3-=I2+5SO32-+3H++H2O ![]() 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Na2FeO4有强氧化性可以杀菌消毒,其还原产物Fe3+能水解产生Fe(OH)3胶体而净水
4Fe(OH)2+O2+2H2O=4Fe(OH)3 Na2FeO4有强氧化性可以杀菌消毒,其还原产物Fe3+能水解产生Fe(OH)3胶体而净水
【解析】
对于分子晶体来说,一般认为相对分子质量越大,沸点越高,对于有些氢化物,如果沸点出现反常,则考虑分子间形成氢键。
I.(1)碘的原子结构示意图为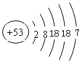 ,它在元素周期表的位置为第五周期 ⅦA族;HF的沸点比HI高,原因是HF分子间能形成氢键;
,它在元素周期表的位置为第五周期 ⅦA族;HF的沸点比HI高,原因是HF分子间能形成氢键;
(2)NaHSO3具有还原性,能将NaIO3还原为I2,反应的离子方程式2IO3-+5HSO3-=I2+5SO32-+3H++H2O;
II:(1)铁(26号元素)的原子结构示意图为![]() ;
;
(2)氢氧化亚铁接触空气易被氧化为氢氧化铁,变色过程中发生的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)Na2FeO4是新型水处理剂,其在水处理中的作用和原因Na2FeO4有强氧化性可以杀菌消毒,其还原产物Fe3+能水解产生Fe(OH)3胶体而净水。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入 1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
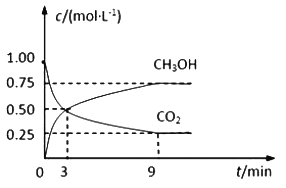
(1)从3 min到9 min,υ(H2)=________mol·L-1·min-1。
(2)能说明上述反应达到平衡状态的是____________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)平衡时CO2的转化率为______________。
(4)平衡时混合气体中CH3OH(g)的体积分数是__________________。
(5)一定温度下,第9分钟时υ逆(CH3OH) _______(填“大于”、“小于”或“等于”)第3分钟时υ正(CH3OH)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CO混合气体共8mol,通入足量Na2O2中,并且用电火花持续引爆,充分反应后,剩余气体1mol,则固体增重为多少克?( )
A.56gB.168gC.224gD.196g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】()下表是25℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为___。
(2)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是(填“>”、“<”或“=”):CH3COOK___NaClO,两溶液中:[c(Na+)-c(ClO-)]___[c(K+)-c(CH3COO-)]。
(3)向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=___。
(4)碳酸钠溶液中滴加少量氯水的离子方程式为___。
(Ⅱ)H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
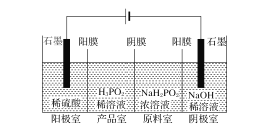
(1)写出阳极的电极反应式___。
(2)分析产品室可得到H3PO2的原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列情况会使所配溶液浓度偏低或其它测量值偏低的是( )
①滴定实验中配制标准碱液时,所用砝码生锈
②用滴定管量取a.00mL液体时,开始时平视读数,结束时俯视读数
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④在用标准液(已知浓度)滴定未知溶液时,标准液滴定管水洗未润洗
⑤定容时,仰视容量瓶的刻度线
⑥在用标准液(已知浓度)滴定未知溶液时,滴定前无气泡滴定后有气泡
⑦滴定前有气泡,滴定终点无气泡
⑧用蒸馏水洗净锥形瓶后盛入待测NaOH溶液进行滴定
A. ①③⑤⑥B. ①②⑤⑦C. ②③④⑧D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g)![]() Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
T/K | 938 | 1 100 |
K | 0.68 | 0.40 |
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量_____;充入氦气,混合气体的密度____(填“增大”“减小”或“不变”)。
(2)830℃,反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的平衡常数K=1,在2L恒容反应器中发生上述反应,分别充入3mol CO2,,2mol H2,1mol CH3OH,4mol H2O,反应向__方向进行。(填左/右)
CH3OH(g)+H2O(g)的平衡常数K=1,在2L恒容反应器中发生上述反应,分别充入3mol CO2,,2mol H2,1mol CH3OH,4mol H2O,反应向__方向进行。(填左/右)
(3)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①上述盐溶液中的阴离子,结合质子能力最强的是______。
②根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最强的是____;将各溶液分别稀释100倍,pH变化最小的是_____(填编号)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
③据上表数据,请你判断下列反应不能成立的是___(填编号)。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
具有自主知识产权、中国制造的C919,是一款与波音737MAX同等体量的民用飞机。制造C919需要大量的合金材料,其中包括钢,钢是现代社会的物质基础,钢中除含有铁外还含有碳和少量不可避免的硅、锰、磷、硫等元素。请回答下列有关问题:
(1)基态Mn2+的价电子排布图为___________。
(2)NO2的立体构型名称为___________,其中心原子的杂化方式为___________。
(3)写出和CN-互为等电子体的一种分子的电子式___________。
(4)铵盐大多易分解,NH4F和NH4Br两种盐中较难分解的是______(填化学式);理由是_______。
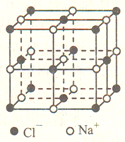
(5) 氧化亚铁晶胞与NaC1的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为apm,该晶体的密度ρ=___________________ g·cm-3 (列出计算式即可,用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸溶液是常用的消毒剂和漂白剂。某学习小组根据需要欲制备浓度不小于0.8mol/L的次氯酸溶液。
资料1:常温常压下,Cl2O为棕黄色气体,沸点为3.8℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水立即反应生成 HClO。
资料2:将氯气和空气(不参与反应)按体积比1∶3混合通入潮湿的碳酸钠中发生反应2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,用水吸收Cl2O(不含Cl2)制得次氯酸溶液。
(装置及实验)用以下装置制备次氯酸溶液。
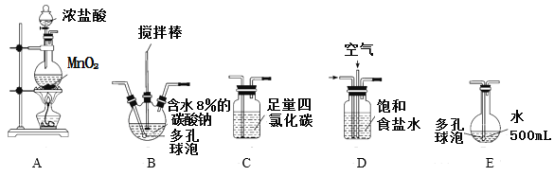
回答下列问题:
(1)各装置的连接顺序为_____→_____→_____→____→E。
(2)装置A中反应的离子方程式是__________________________。
(3)实验中控制氯气与空气体积比的方法是_____________________。
(4)反应过程中,装置B需放在冷水中,其目的是_________________________。
(5)装置E采用棕色圆底烧瓶是因为______________________。
(6)若装置B中生成的Cl2O气体有20%滞留在E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol/L,则至少需要含水8%的碳酸钠的质量为_________g。
(7)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定E中次氯酸溶液的物质的量浓度的实验方案为:用________________准确量取20.00 mL次氯酸溶液,加入足量的________溶液,再加入足量的________溶液,过滤,洗涤,真空干燥,称量沉淀的质量。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,被科学家们高度评价为“稻草变黄金”。下列有关说法中,你认为错误的是( )
A. Na的还原性强于金刚石B. 另一种化合物是NaCl
C. 纳米级金刚石粉末可以透过半透膜D. 这个反应是置换反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com