
【题目】下列情况会使所配溶液浓度偏低或其它测量值偏低的是( )
①滴定实验中配制标准碱液时,所用砝码生锈
②用滴定管量取a.00mL液体时,开始时平视读数,结束时俯视读数
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④在用标准液(已知浓度)滴定未知溶液时,标准液滴定管水洗未润洗
⑤定容时,仰视容量瓶的刻度线
⑥在用标准液(已知浓度)滴定未知溶液时,滴定前无气泡滴定后有气泡
⑦滴定前有气泡,滴定终点无气泡
⑧用蒸馏水洗净锥形瓶后盛入待测NaOH溶液进行滴定
A. ①③⑤⑥B. ①②⑤⑦C. ②③④⑧D. ③④⑤⑥
【答案】A
【解析】
①配制标准碱液时,所用砝码生锈,所称碱的质量增大,即所配溶液的浓度偏高,滴定实验中,利用c(待)=![]() ,消耗标准液体积减小,所测未知液的浓度偏低,故①符合题意;
,消耗标准液体积减小,所测未知液的浓度偏低,故①符合题意;
②用滴定管量取a.00mL液体时,开始时平视读数,结束时俯视读数,所量取的液体体积偏高,故②不符合题意;
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤,造成容量瓶中溶质的物质的量减小,即所配溶液的浓度偏低,故③符合题意;
④标准液滴定管水洗未润洗,稀释标准液,消耗标准液的体积偏大,故④不符合题意;
⑤定容时,仰视容量瓶的刻度线,所加水的体积偏大,浓度偏低,故⑤符合题意;
⑥滴定前无气泡滴定后有气泡,导致标准液的体积偏低,未知溶液的浓度偏低,故⑥符合题意;
⑦滴定前有气泡,滴定终点无气泡,消耗标准液的体积偏高,未知溶液的浓度偏高,故⑦不符合题意;
⑧用蒸馏水洗净锥形瓶后盛入待测NaOH溶液进行滴定,NaOH物质的量不变,对实验结果无影响,故⑧不符合题意;
综上所述选项A正确;
答案选A。


科目:高中化学 来源: 题型:
【题目】“共生系统”能很大程度上提高经济效益。研究硫酸工业尾气的“共生系统”具有重要意义。回答下列问题:
(1)工业上,将Na2CO3和Na2S以合适的物质的量比配成溶液,吸收富集的SO2,可制取重要的化工原料Na2S2O3,同时放出CO2。该反应的化学方程式为___________________。
(2)工业上,将富含SO2的工业尾气降温液化,收集液态SO2。用液态SO2、硫磺(用S表示)、液氯为原料,在200℃~250℃活性炭催化条件下合成氯化剂SOCl2。该反应中氧化剂与还原剂的物质的量之比为________________。
(3)SOCl2分子的空间构型为______________。下列关于O、S、Se三种同主族元素的叙述正确的是____________(填序号)。
a.沸点:H2O>H2S>H2Se
b.H2O分子中H—O—H键的键角小于H2S分子中H—S—H键的键角
c.热稳定性H2O>H2S>H2Se
d.CS2是一种直线型分子,分子中C、S原子都满足8电子稳定结构
(4)氯化亚砜(SOCl2,易挥发液体,易水解)常用作脱水剂。ZnCl2·xH2O制取无水ZnCl2流程如图所示:
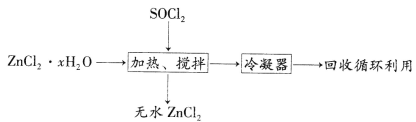
①利用SOCl2和ZnCl2·xH2O混合加热可制得无水ZnCl2的原因是_________________________________(用化学方程式和必要的文字解释)。
②甲同学认为SOCl2也可用于FeCl3·6H2O制取无水FeCl3,但乙同学认为该过程会发生氧化还原反应。要验证乙同学观点是否正确,可选择下列试剂中的___________(填序号)。
a.K3[Fe(CN)6]溶液 b.BaCl2溶液和稀盐酸
c.AgNO3溶液和稀硝酸 d.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )

A.反应①②③④⑤均属于氧化还原反应,反应③还属于置换反应
B.反应⑤说明该条件下铝可用于制熔点较高的金属
C.相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶1
D.反应①中氧化剂与还原剂的物质的量之比为1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:
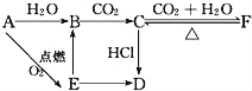
(1)写出A、B、C、D、E、F的化学式:
A.___,B.___,C.___,D.___,E.___,F.___。
(2)写出有关反应的化学方程式(是离子反应的直接写离子方程式)。
A→E:___,
E→B:___,
F→C:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):
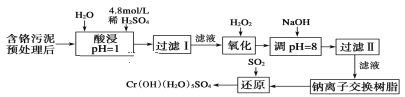
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | - | - | 4.7 | - |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是___(写一条即可)。
(2)调pH=8是为了除去___(填Fe3+、Al3+、Ca2+、Mg2+)。
(3)试配平氧化还原反应方程式:_Na2Cr2O7+_SO2+_H2O=________Cr(OH)(H2O)5SO4+_Na2SO4;每生成1molCr(OH)(H2O)5SO4消耗SO2的物质的量为___。
(4)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+ 和Fe2+的实验步骤:①___;②___;③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I碘是人类发现的第二个生命科学必需微量元素。回答下列问题:
(1)碘在元素周期表的位置为______________;HF的沸点比HI_________(填“高”或“低”)。原因是_____________________________
(2)自然界中的碘有的以NaIO3形态存在于硝石(NaNO3)中,向硝石母液中加入NaHSO3可以制得I2,请写出NaIO3溶液和NaHSO3溶液反应的离子方程式___________________。
II:2019年有科学家发表在《自然》科学杂志上的研究认为:细菌和灵长类动物铁元素争夺战是物种存活的一个决定性因素。请结合你所学的知识回答下列问题:
(1)铁(26号元素)的原子结构示意图为_______________________
(2)写出氢氧化亚铁接触空气变色过程中发生的化学方程式_________________________
(3)Na2FeO4是新型水处理剂,简述其在水处理中的作用和原因_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列提供的一组物质回答问题:
①NH4Cl ②MgCl2 ③H2S ④Na2O2 ⑤MgO ⑥Cl2 ⑦NaOH
(1)仅含有共价键的是_________;既有离子键又有共价键的是_________(用序号表示)
(2)离子化合物有_____________________;(用序号表示)
(3)Na2O2 的电子式_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是( )
A. 现有CO、CO2、O3三种气体,它们分别都含有1 mol O,则三种气体的物质的量之比为3∶2∶1
B. 28 g CO和22.4 L CO2中含有的碳原子数一定相等
C. 标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32
D. a g Cl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2﹣、Cl﹣等,其中HClO2和ClO2都具有漂白作用.已知pOH=﹣lgc(OH﹣),经测定25℃时各组分含量随pOH变化情况如图所示(Cl﹣没有画出),此温度下,下列分析正确的是
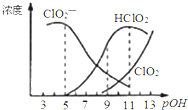
A.HClO2的电离平衡常数的数值Ka=10﹣6
B.亚氯酸钠在酸性条件下较稳定
C.pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2﹣)>c(ClO2)>c(Cl﹣)
D.同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)-2c(H+)=c(ClO2﹣)-2c(OH﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com