
【题目】亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2﹣、Cl﹣等,其中HClO2和ClO2都具有漂白作用.已知pOH=﹣lgc(OH﹣),经测定25℃时各组分含量随pOH变化情况如图所示(Cl﹣没有画出),此温度下,下列分析正确的是
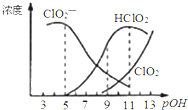
A.HClO2的电离平衡常数的数值Ka=10﹣6
B.亚氯酸钠在酸性条件下较稳定
C.pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2﹣)>c(ClO2)>c(Cl﹣)
D.同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)-2c(H+)=c(ClO2﹣)-2c(OH﹣)
【答案】A
【解析】
A.HClO2的电离平衡常数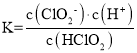 ,观察图象可以看出,当pOH=8时,pH=6,c(ClO2)=c(HClO2),因此HClO2的电离平衡常数的数值Ka=106,故A正确;
,观察图象可以看出,当pOH=8时,pH=6,c(ClO2)=c(HClO2),因此HClO2的电离平衡常数的数值Ka=106,故A正确;
B. 由图可以得出:碱性条件下ClO2浓度高,即在碱性条件下亚氯酸钠较稳定,而不是在酸性条件下稳定,故B错误;
C. 根据图知,pH=7时,存在c(HClO2)<c(ClO2),则微粒浓度大小顺序是c(ClO2)>c(HClO2)>c(ClO2)>c(Cl),故C错误;
D. 依据电中性原则得出:c(H+)+c(Na+)=c(ClO2)+c(Cl)+c(OH)①,依据物料守恒得出:2c(Na+)=c(ClO2)+c(HClO2)+c(Cl)②,联立①②消去钠离子:c(HClO2)+2c(H+)=c(ClO2)+2c(OH)+c(Cl),故D错误,
故选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列情况会使所配溶液浓度偏低或其它测量值偏低的是( )
①滴定实验中配制标准碱液时,所用砝码生锈
②用滴定管量取a.00mL液体时,开始时平视读数,结束时俯视读数
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④在用标准液(已知浓度)滴定未知溶液时,标准液滴定管水洗未润洗
⑤定容时,仰视容量瓶的刻度线
⑥在用标准液(已知浓度)滴定未知溶液时,滴定前无气泡滴定后有气泡
⑦滴定前有气泡,滴定终点无气泡
⑧用蒸馏水洗净锥形瓶后盛入待测NaOH溶液进行滴定
A. ①③⑤⑥B. ①②⑤⑦C. ②③④⑧D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)如图1是一个化学过程的示意图。
①甲池中OH-移向______极(填“CH3OH”或“O2”)。
②写出通入CH3OH的电极的电极反应式_________。
③乙池中总反应的离子方程式____________。
④当乙池中B(Ag)极的质量增加5.40g,此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是________
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
(2)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图2所示原电池,回答下列问题:
①写出电极反应式:正极________;负极___________。
②图中X溶液是________,Y溶液是_________。
③原电池工作时,盐桥中的______(填“阳”或“阴”)离子向X溶液方向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___。
(2)该反应为___反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是___(多选扣分)。
a.υ正(H2)=υ逆(H2O) b.反应停止,正、逆反应速率都等于零
c.容器中压强不再发生变化 d.混合气体中c(CO2)不变
(4)某温度下,在2L的密闭容器中,加入1 molCO2和1molH2充分反应达平衡时,CO平衡浓度为0.25mol/L,试判断此时的温度为__℃。
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,CO2的平衡转化率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还有少量杂质)是提取铝的原料。提取铝的工艺流程如下:
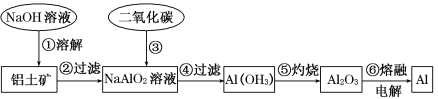
(1)请用离子方程式表示以上工艺流程中第①步反应:_____________________。
(2)写出以上工艺流程中第③步反应的化学方程式:___________________________。
(3)若第①步加入的是盐酸,则发生反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,被科学家们高度评价为“稻草变黄金”。下列有关说法中,你认为错误的是( )
A. Na的还原性强于金刚石B. 另一种化合物是NaCl
C. 纳米级金刚石粉末可以透过半透膜D. 这个反应是置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备锌印刷电路板是用稀硝酸腐蚀锌板产生的废液称“烂板液”。“烂板液”中除含硝酸锌外,还含有自来水带入的Cl-和Fe3+,在实验室里,用“烂板液制取ZnSO47H2O的过程如图所示
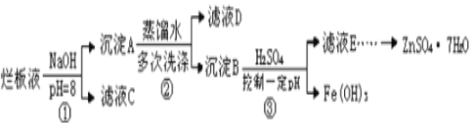
(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是____。
(2)若步骤①的pH>12,则Zn(OH) 2溶解生成四羟基合锌酸钠,Zn(OH) 2溶解的离子方程式为_____。
(3)滤液D中除了含有OH-离子外,还含有的阴离子有___________(填离子符号)。
(4)若滤液E的pH=4,c(Zn2+)=2mol·L-1,c(Fe3+)=2.6×10-9mo·L-l试求出Fe(OH)3的溶度积常数__(只需写出结果即可)。
(5)已知:①Fe(OH)3(s) Fe3+(aq)+3OH-(aq)H=a kJ mol·L-1②H2O(l) H+(aq)+OH-(aq)H=b kJ·mol·L-1,若①的溶度积常数为Ksp,②的离子积常数为Kw,Fe3+发生水解反应的平衡常数:K=____(用含Kw、Ksp的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示,下列说法错误的是
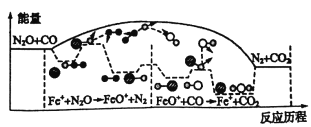
A. 反应总过程△H<0
B. Fe+使反应的活化能减小
C. 总反应若在2L的密闭容器中进行,温度越高反应速率一定越快
D. Fe++N2O→FeO++N2、FeO++CO→Fe++CO2两步反应均为放热及应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁单质及其化合物在生活、生产中应用广泛。请回答下列问题:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为___________________。
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是________________________________________________________________________。
(3)硫酸铁可作絮凝剂,常用于净水,其原理是______________________________(用离子方程式表示)。在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是______________________________。
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是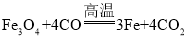 ,若有1.5mol Fe3O4参加反应,转移电子的物质的量是__________。
,若有1.5mol Fe3O4参加反应,转移电子的物质的量是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com