
����Ŀ���Ʊ�пӡˢ��·������ϡ���ḯʴп������ķ�Һ�����ð�Һ�������ð�Һ���г�������п�⣬����������ˮ�����Cl����Fe3+����ʵ����������ð�Һ��ȡZnSO47H2O�Ĺ�����ͼ��ʾ
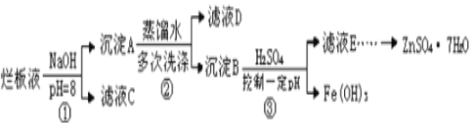
��1����ϡ���ḯʴп��ʱ��ԭ����ΪN2O���������뻹ԭ�������ʵ���֮����____��
��2��������ٵ�pH��12����Zn(OH) 2�ܽ��������ǻ���п���ƣ�Zn(OH) 2�ܽ�����ӷ���ʽΪ_____��
��3����ҺD�г��˺���OH-�����⣬�����е���������___________�������ӷ��ţ���
��4������ҺE��pH��4��c(Zn2��)��2mol��L-1,c(Fe3��)��2.6��10-9mo��L-l�����Fe(OH)3���ܶȻ�����__��ֻ��д��������ɣ���
��5����֪:��Fe(OH)3��s�� Fe3����aq����3OH����aq��H��a kJ mol��L-1��H2O(l) H����aq����OH����aq��H��b kJ��mol��L-1�����ٵ��ܶȻ�����ΪKsp���ڵ����ӻ�����ΪKw��Fe3������ˮ�ⷴӦ��ƽ�ⳣ��:K��____���ú�Kw��Ksp�Ĵ���ʽ��ʾ����
���𰸡�1:2 Zn(OH)2+2OH=[Zn(OH)4]2 Cl��NO3 2.6��10-39 ![]()
��������
����ʵ��Ŀ�ļ�����ͼ�������������ķ�Ӧ��������ɣ���д��ط�Ӧ���ӷ���ʽ�����ݵ��뼰ˮ��ԭ��������ƽ�ⳣ������ʽ������ؼ��㡣
��Ϊ��Һ����ϡ���ḯʴп���õ��ģ����Է�Һ�к��д�����п���ӡ������ӡ���������Ӻ�������Cl��Fe3+�������������Ƶ�����Һ��pH=8ʹ�����ӡ�п������ȫ������Ȼ���ڳ���B�м����Ტ����pH��ʹ��������������п�����ܽ�õ�����п��Һ�����յõ�����п���壻
(1)��ϡ���ḯʴп��ʱ��ԭ����ΪN2O����Ӧ�ķ���ʽΪ4Zn+10HNO3=4Zn(NO3)2+N2O��+5H2O���ɷ���ʽ��֪��Ӧ��HNO3Ϊ��������ZnΪ��ԭ������4molZn�μӷ�Ӧʱ����2molHNO3����ԭ�����������뻹ԭ�������ʵ���֮��1:2���ʴ�Ϊ��1:2��
(2)Zn(OH)2�ܽ��������ǻ���п���ƣ���Ӧ�����ӷ���ʽΪZn(OH)2+2OH=[Zn(OH)4]2��
�ʴ�Ϊ��Zn(OH)2+2OH=[Zn(OH)4]2��
(3)������������ԣ�����A��������Һ�е�Cl��NO3�����ӣ�����Һ��Ӧ����Cl��NO3���ʴ�Ϊ��Cl��NO3��
��4������ҺE��pH��4����c(OH-)��1��10-10mo��L-l���õ��ij���ΪFe(OH)3����Fe(OH)3���ܶȻ�����Ϊ��![]() ���ʴ�Ϊ��2.6��10-39��
���ʴ�Ϊ��2.6��10-39��
��5��Fe3+����ˮ�ⷴӦ�ķ���ʽΪFe3++3H2O![]() Fe(OH)3+3H+����֪��Fe(OH)3��s�� Fe3����aq����3OH����aq��
Fe(OH)3+3H+����֪��Fe(OH)3��s�� Fe3����aq����3OH����aq��![]() �� ��H2O(l) H����aq����OH����aq��
�� ��H2O(l) H����aq����OH����aq�� ![]() �������3�ٿɵ�Fe3+(aq)+3H2O(l)Fe(OH)3(aq)+3H+(aq)����Fe3+����ˮ�ⷴӦ��ƽ�ⳣ��Ϊ��
�������3�ٿɵ�Fe3+(aq)+3H2O(l)Fe(OH)3(aq)+3H+(aq)����Fe3+����ˮ�ⷴӦ��ƽ�ⳣ��Ϊ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ṩ��һ�����ʻش����⣺
��NH4Cl ��MgCl2 ��H2S ��Na2O2 ��MgO ��Cl2 ��NaOH
��1�������й��ۼ�����_________���������Ӽ����й��ۼ�����_________(����ű�ʾ��
��2�����ӻ�������_____________________��������ű�ʾ��
��3��Na2O2 �ĵ���ʽ_____________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ע�����м�������Na2SO3���壬����������Ũ���ᣨ�Բ��Ӵ�ֽ��Ϊ�����������й�˵����ȷ���ǣ�������
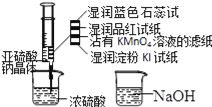
A. ʪ����۵⻯����ֽδ����˵����Ԫ�صķǽ�����ǿ�ڵ�Ԫ��
B. մ��KMnO4��Һ����ֽ��ɫ֤����SO2����Ư����
C. ʵ��ɰ�ע�����е����ʻ�������NaOH��Һ�У��Լ��ٻ�����Ⱦ
D. ��ɫʯ����ֽ���˵��SO2������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƣ�NaClO2������Ư��֯���ά��ֽ�������ж���ά����С���ص㣮������Һ�п�����ClO2��HClO2��ClO2����Cl���ȣ�����HClO2��ClO2������Ư�����ã���֪pOH=��lgc(OH��)�����ⶨ25��ʱ����ֺ�����pOH�仯�����ͼ��ʾ��Cl��û�л����������¶��£����з�����ȷ����
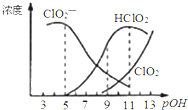
A.HClO2�ĵ���ƽ�ⳣ������ֵKa=10��6
B.�������������������½��ȶ�
C.pH=7ʱ����Һ�к�������Ũ�ȴ�СΪ��c(HClO2)��c(ClO2��)��c(ClO2)��c(Cl��)
D.ͬŨ�ȵ�HClO2��Һ��NaClO2��Һ�������ϣ�������Һ����c(HClO2)-2c(H+)=c(ClO2��)-2c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�����ȵġ��ݻ��̶����ܱ������У��������淴ӦmA(g)��nB(g)![]() pC(g)��qD(g)(m��n��p��qΪ����������)��������˵���ÿ��淴Ӧ�ﵽƽ��״̬����(����)
pC(g)��qD(g)(m��n��p��qΪ����������)��������˵���ÿ��淴Ӧ�ﵽƽ��״̬����(����)
�ٻ��������ܶȲ��ٷ����仯������ϵ���¶Ȳ��ٷ����仯����A��ת���ʲ��ٸı䡡�ܸ���ֵİٷֺ������ٸı䡡�ݷ�Ӧ����v(A)��v(B)��v(C)��v(D)��m��n��p��q
A. �ڢۢ�B. �٢ۢ�C. �ڢܢ�D. �٢ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ž��з���Ԫ��������150���ꡣ�±���Ԫ�����ڱ���һ���֣�W��X��Y��ZΪ����������Ԫ�أ�W��X������ϼ�֮��Ϊ8������˵���������

A. ԭ�Ӱ뾶��W<X
B. ���³�ѹ�£�Y����Ϊ��̬
C. ��̬�⻯�����ȶ��ԣ�Z<W
D. X������������ˮ������ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У�����ת�Ʒ�����ͬ�����ʵ�ͬ��Ԫ��֮����ǣ� ��
A. 2H2S��SO2��3S��2H2OB. 2KMnO4![]() K2MnO4��MnO2��O2��
K2MnO4��MnO2��O2��
C. 2KClO3![]() 2KCl��3O2��D. Cu2O��H2SO4=CuSO4��Cu��H2O
2KCl��3O2��D. Cu2O��H2SO4=CuSO4��Cu��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���߷��Ӳ���PET������֬��PMMA�ĺϳ�·������ͼ:
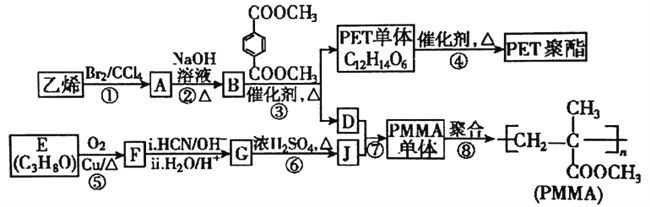
��֪:
I.RCOOR+R "OH![]() RCOOR "+ROH (R.R'��R"��������)
RCOOR "+ROH (R.R'��R"��������)
II.  (R��������)��
(R��������)��
(1)PMMA����Ľṹ��ʽΪ_______��PET�����еĹ���������Ϊ________��
(2)��Ӧ�ݵķ�Ӧ������________����Ӧ�ڵĻ�ѧ����ʽΪ_________��
(3)����Ӧ�ܵõ���ijһ����״����ۺ϶�Ϊn�������۷�Ӧ����ȥ��С��������___������
(4)PMMA�����ж���ͬ���칹�壬ij���칹��K�����������ʣ��ٲ��ܷ���������Ӧ�ڲ���ʹ��ˮ��ɫ�۷�����û�л�״�ṹ�ܺ˴Ź��������������Ϊ3:1�����ַ壬��K�Ľṹ��ʽΪ:__________����һ���칹��H����ȩ�����ǻ���̼̼˫������ͭ������������������������һ�֣���H�����Ľṹ����___��(�����������칹�Ϳռ��칹)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���� CH3CH=CHCH2CH3![]() CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
�� R-CH=CH2![]() R-CH2-CH2-Br
R-CH2-CH2-Br
�㶹�صĺ��Ľṹ�Ƿ�������A��A�����в���ת��Ϊˮ���ᡣ
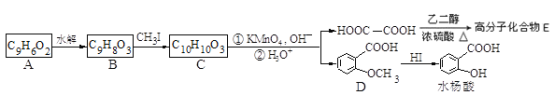
��ش��������⣺
��1�������й�A��B��C�������в���ȷ����___________
a. C�к˴Ź���������8�ַ�
b. A��B��C���ɷ����Ӿ۷�Ӧ
c. 1mol A����ܺ�5mol���������ӳɷ�Ӧ
d. B����Ũ��ˮ����ȡ����Ӧ
��2��B��������2�����������ţ��ֱ�Ϊ______��______������������ƣ���B��C�ķ�Ӧ����Ϊ_____________��
��3��������ת�������У���Ӧ����B��C��Ŀ����_________________________��
��4��������D�ж���ͬ���칹�壬����һ��ͬ���칹���DZ��ĶԶ�ȡ�����ˮ������ɵIJ���֮һ�ܷ���������Ӧ����д������һ�ֵĽṹ��ʽ��_____________��
��5��д���ϳɸ߷��ӻ�����E�Ļ�ѧ��Ӧ����ʽ��_______________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com