
【题目】铝土矿(主要成分为Al2O3,还有少量杂质)是提取铝的原料。提取铝的工艺流程如下:
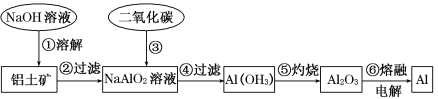
(1)请用离子方程式表示以上工艺流程中第①步反应:_____________________。
(2)写出以上工艺流程中第③步反应的化学方程式:___________________________。
(3)若第①步加入的是盐酸,则发生反应的离子方程式为_________________________。
【答案】Al2O3+2OH-===2AlO2-+H2O NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3 Al2O3+6H+===2Al3++3H2O
【解析】
氧化铝为两性氧化物,既能与盐酸反应,也能和氢氧化钠反应;二氧化碳和偏铝酸钠反应生成氢氧化铝和碳酸氢钠,据此分析解答。
(1)氧化铝属于两性氧化物,能溶于强酸和强碱,所以氧化铝和氢氧化钠反应生成可溶性的偏铝酸钠和水,离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(2)向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀和碳酸氢钠,发生的反应为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,故答案为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;
(3)氧化铝与盐酸反应Al2O3+6HCl=2AlCl3+3H2O,离子方程式为Al2O3+6H+=2Al3++3H2O,故答案为:Al2O3+6H+=2Al3++3H2O。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
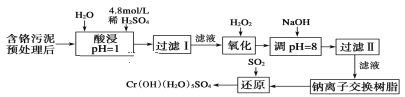
【题目】某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | - | - | 4.7 | - |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是___(写一条即可)。
(2)调pH=8是为了除去___(填Fe3+、Al3+、Ca2+、Mg2+)。
(3)试配平氧化还原反应方程式:_Na2Cr2O7+_SO2+_H2O=________Cr(OH)(H2O)5SO4+_Na2SO4;每生成1molCr(OH)(H2O)5SO4消耗SO2的物质的量为___。
(4)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+ 和Fe2+的实验步骤:①___;②___;③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】17.4g MnO2与240 mL 10 mol/L(密度为1.10g/mL)的盐酸(足量)混合加热(不考虑盐酸挥发),使其充分反应后,再向溶液中加入足量的AgNO3溶液。(已知:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O)
MnCl2+Cl2↑+2H2O)
试求:(1)10 mol/L的盐酸的质量分数____________
(2)产生的气体在标准状况下的体积______________;
(3)产生沉淀的质量_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
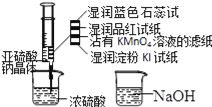
A. 湿润淀粉碘化钾试纸未变蓝说明硫元素的非金属性强于碘元素
B. 沾有KMnO4溶液的滤纸褪色证明了SO2具有漂白性
C. 实验后,可把注射器中的物质缓缓推入NaOH溶液中,以减少环境污染
D. 蓝色石蕊试纸变红说明SO2显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学完元素周期理论之后,某同学欲探究硫、碳、硅元素非金属性的相对强弱,设计如下'实验:
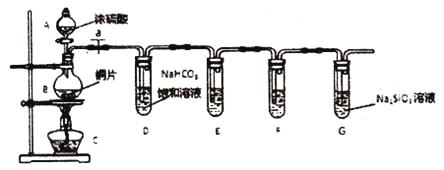
回答下列问题:
(1)填写所示仪器名称:A_________、B___________。
(2)实验步骤:连接仪器、________、加药品后,打开a,然后滴入浓硫酸,加热。烧瓶中反应的化学方程式为___________________________________。
(3)问题探究:
①试管D中发生反应的离子方程式是_________________________。
②甲同学发现装置E中所盛品红溶液颜色无明显变化,F中所盛澄清石灰水变浑浊,据此认定硫元素的非金属性强于碳,而乙同学不同意甲的观点,其理由是_______________________________。
③装置G中出现的实验现象为______________,即可证明碳元素的非金属性强于硅元素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2﹣、Cl﹣等,其中HClO2和ClO2都具有漂白作用.已知pOH=﹣lgc(OH﹣),经测定25℃时各组分含量随pOH变化情况如图所示(Cl﹣没有画出),此温度下,下列分析正确的是
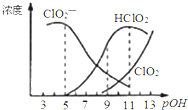
A.HClO2的电离平衡常数的数值Ka=10﹣6
B.亚氯酸钠在酸性条件下较稳定
C.pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2﹣)>c(ClO2)>c(Cl﹣)
D.同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)-2c(H+)=c(ClO2﹣)-2c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个绝热的、容积固定的密闭容器中,发生可逆反应mA(g)+nB(g)![]() pC(g)+qD(g)(m、n、p、q为任意正整数)。下列能说明该可逆反应达到平衡状态的是( )
pC(g)+qD(g)(m、n、p、q为任意正整数)。下列能说明该可逆反应达到平衡状态的是( )
①混合气体的密度不再发生变化 ②体系的温度不再发生变化 ③A的转化率不再改变 ④各组分的百分含量不再改变 ⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
A. ②③④B. ①③⑤C. ②④⑤D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,电子转移发生在同种物质的同种元素之间的是( )
A. 2H2S+SO2=3S+2H2OB. 2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
C. 2KClO3![]() 2KCl+3O2↑D. Cu2O+H2SO4=CuSO4+Cu+H2O
2KCl+3O2↑D. Cu2O+H2SO4=CuSO4+Cu+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态,铈的合金耐高温,可以用来制造喷气推进器零件。
请回答下列问题:
(1)雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(二者物质的量之比为1:1),该反应氧化剂与还原剂的物质的量之比为________。
(2)可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。

①Ce4+从电解槽的______(填字母序号)口流出。
②写出阴极的电极反应式________________。
(3)铈元素在自然界中主要以氟碳矿形式存在。主要化学成分为CeFCO3。工业上利用氟碳铈矿提取CeCl3的一种工艺流程如下:

①焙烧过程中发生的主要反应方程式为__________________。
②有同学认为酸浸过程中用稀硫酸和H2O2替换盐酸更好,他的理由是_________。
③Ce(BF4)3、KBF4的Ksp分别为a、b,则Ce(BF4)3(s)+3KCl(aq)![]() 3KBF4(s)+CeCl3(aq)平衡常数为________(用a、b的代数式表示)。
3KBF4(s)+CeCl3(aq)平衡常数为________(用a、b的代数式表示)。
④加热CeCl3·6H2O和NH4Cl的固体混合物可得固体无水CeCl3,其中NH4Cl的作用是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com