
【题目】某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):
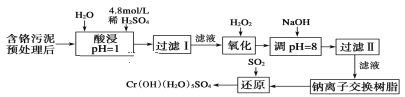
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | - | - | 4.7 | - |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是___(写一条即可)。
(2)调pH=8是为了除去___(填Fe3+、Al3+、Ca2+、Mg2+)。
(3)试配平氧化还原反应方程式:_Na2Cr2O7+_SO2+_H2O=________Cr(OH)(H2O)5SO4+_Na2SO4;每生成1molCr(OH)(H2O)5SO4消耗SO2的物质的量为___。
(4)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+ 和Fe2+的实验步骤:①___;②___;③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。
【答案】升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取)、适当延长浸取时间 Fe3+、Al3+ 1 3 11 2 1 1.5mol 通入足量氯气将Fe2+氧化成Fe3+ 加入CuO调节溶液的pH至3.2~4.7
【解析】
硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+和Mg2+,双氧水有强氧化性,能氧化还原性的物质,Fe2+和Cr3+有还原性,Fe2+和Cr3+能被双氧水氧化为高价离子,以便于与杂质离子分离;加入NaOH溶液调pH=8,Fe3+、Al3+转化为沉淀除去;最后钠离子交换树脂交换的离子是钙离子和镁离子,据此分析。
硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+和Mg2+,双氧水有强氧化性,能氧化还原性的物质,Fe2+和Cr3+有还原性,Fe2+和Cr3+能被双氧水氧化为高价离子,以便于与杂质离子分离;加入NaOH溶液调pH=8,Fe3+、Al3+转化为沉淀除去;最后钠离子交换树脂交换的离子是钙离子和镁离子。
I、(1)酸浸时,为了提高浸取率可采取的措施是:升高温度、适当延长浸取时间、不断搅拌混合物、滤渣多次浸取等,
故答案为:升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取)、适当延长浸取时间;
(2)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+和Mg2+,加入H2O2将Fe2+和Cr3+氧化,加入NaOH溶液调pH=8,Fe3+、Al3+转化为沉淀除去;
故答案为:Fe3+、Al3+;
(3)反应中,Na2Cr2O7中Cr元素的化合价由+6价降至Cr(OH)(H2O)5SO4中+3价,1molNa2Cr2O7得到6mol电子,S元素的化合价由+4价升至+6价,1molSO2失去2mol电子,根据得失电子守恒、原子守恒,配平后的方程式为:Na2Cr2O7+3SO2+11H2O=2Cr(OH)(H2O)5SO4+Na2SO4,
根据方程式:3SO2~2 Cr(OH)(H2O)5SO4
3 mol 2mol
n(SO2) 1mol
所以n(SO2)=1.5mol;
(4)根据上表给出的数据和提供的药品,除去CuCl2溶液中Fe3+和Fe2+的实验步骤是:通入足量的氯气将Fe2+氧化为Fe3+、加入CuO调节溶液pH值3.2~4.7使铁离子沉淀完全,然后过滤,
故答案为:①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2~4.7。


科目:高中化学 来源: 题型:
【题目】(Ⅰ)如表是A、B两种有机物的有关信息:
A | B |
①分子模型为: ②能使溴的四氯化碳溶液褪色; ③其产量是衡量石油化工水平的标志。 | ①由C、H、O三种元素组成,是厨房中的常见调味剂; ②水溶液能使紫色石蕊试液变红。 |
根据表中信息回答下列问题:
(1)关于A的下列说法中,不正确的是_____(填标号)。
a.分子里含有碳碳双键 b.分子里所有的原子共平面 c.结构简式为CH2-CH2
(2)A与H2发生加成反应后生成X,与X在分子组成和结构上相似的有机物有一大类,它们的通式为CnH2n+2。当n=___时,这类机物开始出现同分异构休。
(Ⅱ)已知有机物A~F有如图转化关系:
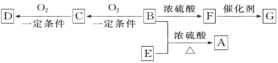
已知:①2CH3CHO+O2![]() 2CH3COOH+2H2O;
2CH3COOH+2H2O;
②CH3CH2OH![]() CH2=CH2↑+H2O(该反应属于消去反应)。
CH2=CH2↑+H2O(该反应属于消去反应)。
③A的分子式为C10H20O2; ④B分子中含2个甲基;⑤D、E互为具有相同官能团的同分异构体,D能与碳酸氢钠反应放出CO2,E分子烃基上的氢原子若被Cl取代,其一氯代物有3种;⑥F可以使溴的四氯化碳溶液褪色,G为高分子化合物。请填写以下空白:
(1)B可以发生的反应有_____(填序号)。
①取代反应 ②消去反应 ③加聚反应 ④氧化反应
(2)D分子所含有的官能团的名称是________。
(3)写出与D、E具有相同官能团的同分异构体(D、E除外)可能的结构简式______。
(4)写出下列转化的化学方程式:
B+E→A:_______;
B→C:___________;
F→G:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH+NH4++HCO3=BaCO3↓+NH3·H2O+H2O
B.将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O
C.用铁电极电解氯化钠溶液:2Cl+2H2O![]() 2OH+H2↑+Cl2↑
2OH+H2↑+Cl2↑
D.将SO2通入Ca(ClO)2溶液中:Ca2++2ClO+SO2+H2O=CaSO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠保存不当容易变质,某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取10.0g样品,并设计用如图装置来测定过氧化钠的质量分数。
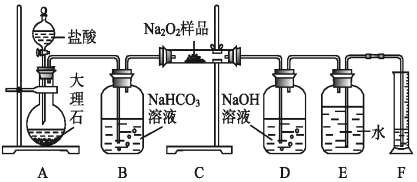
上图中的E和F构成量气装置,用来测定O2的体积。
(1)写出以下装置发生反应的化学方程式:
装置A:___________________________。
装置B:___________________________。
装置C:____________________________。
(2)NaOH溶液的作用是_________________________。
(3)为准确读出氧气的体积需以下操作,正确的顺序为_________。
A.调整量筒高度,使广口瓶E与量筒F内液面相平
B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数
读出量筒内水的体积后,折算成标准状况氧气的体积为1.12L,则样品中过氧化钠的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[一lg c(M2+)]与溶液pH的变化关系如图所示,已知该温度下,Ksp[Cu(OH)2]2],下列说法正确的是 ( )

A. b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1
B. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中:C(Fe2+):C(Cu2+):1:104.6
C. 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
D. 除去CuSO4溶液中含有的少量Fe2+,可加入适量Cu0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列情况会使所配溶液浓度偏低或其它测量值偏低的是( )
①滴定实验中配制标准碱液时,所用砝码生锈
②用滴定管量取a.00mL液体时,开始时平视读数,结束时俯视读数
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④在用标准液(已知浓度)滴定未知溶液时,标准液滴定管水洗未润洗
⑤定容时,仰视容量瓶的刻度线
⑥在用标准液(已知浓度)滴定未知溶液时,滴定前无气泡滴定后有气泡
⑦滴定前有气泡,滴定终点无气泡
⑧用蒸馏水洗净锥形瓶后盛入待测NaOH溶液进行滴定
A. ①③⑤⑥B. ①②⑤⑦C. ②③④⑧D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早使用![]() 金属,在生产生活中应用及其广泛。工业上以黄铜矿 (主要成分FeCuS2)为原料制取金属铜,其主要工艺流程如图所示。
金属,在生产生活中应用及其广泛。工业上以黄铜矿 (主要成分FeCuS2)为原料制取金属铜,其主要工艺流程如图所示。
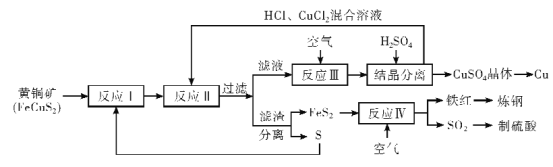
已知:反应II的离子方程式:Cu2++CuS+4Cl-=2[CuCl2]-+S
回答下列问题:
(1)FeCuS2中Fe的化合价__________。
(2)写出一条能使反应I充分进行的措施是_______________________________。
(3)反应III的离子方程式为_________________________________。向反应III后的溶液中加入稀硫酸结晶分离的具体操作为 ____________________。
(4)反应IV的化学方程式为____________________________________。反应IV中,也可以氨水吸收尾气SO2再制成化学肥料,写出氨水吸收SO2的化学方程式_________________
(5)该流程中,可循环利用的物质除CuCl2外,还有___________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有 Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法正确的是
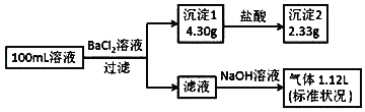
A. 若原溶液中不存在 Na+,则 c(Cl-)<0.1molL﹣1
B. 原溶液可能存在 Cl- 和 Na+
C. 原溶液中 c(CO32-)是 0.01molL﹣1
D. 原溶液一定存在 CO32-和SO42-,一定不存在 Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还有少量杂质)是提取铝的原料。提取铝的工艺流程如下:
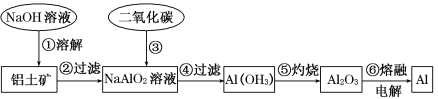
(1)请用离子方程式表示以上工艺流程中第①步反应:_____________________。
(2)写出以上工艺流程中第③步反应的化学方程式:___________________________。
(3)若第①步加入的是盐酸,则发生反应的离子方程式为_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com