
【题目】(Ⅰ)如表是A、B两种有机物的有关信息:
A | B |
①分子模型为: ②能使溴的四氯化碳溶液褪色; ③其产量是衡量石油化工水平的标志。 | ①由C、H、O三种元素组成,是厨房中的常见调味剂; ②水溶液能使紫色石蕊试液变红。 |
根据表中信息回答下列问题:
(1)关于A的下列说法中,不正确的是_____(填标号)。
a.分子里含有碳碳双键 b.分子里所有的原子共平面 c.结构简式为CH2-CH2
(2)A与H2发生加成反应后生成X,与X在分子组成和结构上相似的有机物有一大类,它们的通式为CnH2n+2。当n=___时,这类机物开始出现同分异构休。
(Ⅱ)已知有机物A~F有如图转化关系:
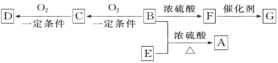
已知:①2CH3CHO+O2![]() 2CH3COOH+2H2O;
2CH3COOH+2H2O;
②CH3CH2OH![]() CH2=CH2↑+H2O(该反应属于消去反应)。
CH2=CH2↑+H2O(该反应属于消去反应)。
③A的分子式为C10H20O2; ④B分子中含2个甲基;⑤D、E互为具有相同官能团的同分异构体,D能与碳酸氢钠反应放出CO2,E分子烃基上的氢原子若被Cl取代,其一氯代物有3种;⑥F可以使溴的四氯化碳溶液褪色,G为高分子化合物。请填写以下空白:
(1)B可以发生的反应有_____(填序号)。
①取代反应 ②消去反应 ③加聚反应 ④氧化反应
(2)D分子所含有的官能团的名称是________。
(3)写出与D、E具有相同官能团的同分异构体(D、E除外)可能的结构简式______。
(4)写出下列转化的化学方程式:
B+E→A:_______;
B→C:___________;
F→G:__________。
【答案】c 4 ①②④ 羧基 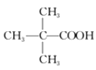 或CH3CH2CH2CH2COOH
或CH3CH2CH2CH2COOH 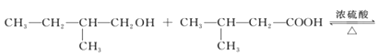
![]() +H2O
+H2O ![]() +O2
+O2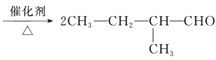 +2H2O n
+2H2O n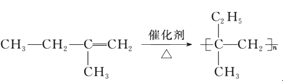
【解析】
(Ⅰ)A分子模型为![]() ,且A能使溴的四氯化碳溶液褪色,其产量是衡量石油化工水平的标志,所以A是乙烯。B是厨房中的常见调味剂,水溶液能使紫色石蕊试液变红,且由C、H、O三种元素组成,所以B为醋酸。
,且A能使溴的四氯化碳溶液褪色,其产量是衡量石油化工水平的标志,所以A是乙烯。B是厨房中的常见调味剂,水溶液能使紫色石蕊试液变红,且由C、H、O三种元素组成,所以B为醋酸。
(1)乙烯的结构简式为CH2=CH2,分子里含有碳碳双键,且分子里所有的原子共平面,故选c;
(2)乙烯与H2发生加成反应后生成乙烷,与乙烷在分子组成和结构上相似的有机物有一大类即烷烃,通式为CnH2n+2。甲烷、乙烷、丙烷都没有同分异构体,从丁烷开始有同分异构体,丁烷有正丁烷和异丁烷两种同分异构体。所以n=4;
(Ⅱ)D能与碳酸氢钠反应放出CO2,说明D分子中有羧基,D、E互为具有相同官能团的同分异构体,说明E也为羧酸。转化关系图中,B氧化成C,C氧化成D,说明B为醇,C为醛。B和E在浓硫酸作用下生成的A为酯。B转化为D的过程中,碳原子数是不变的,而D和E又是同分异构体,所以B和E的碳原子数相同,A有10个碳原子,所以B、C、D、E都有5个碳原子。E分子烃基上的氢原子若被Cl取代,其一氯代物有3种,所以E的结构简式为![]() 。B为醇,而且能氧化成醛,所以B中的羟基连在端点碳原子上,B分子中含2个甲基,所以B的结构简式为
。B为醇,而且能氧化成醛,所以B中的羟基连在端点碳原子上,B分子中含2个甲基,所以B的结构简式为![]() 或
或![]() ,但
,但![]() 转化生成的羧酸为
转化生成的羧酸为![]() ,此为E,所以B为
,此为E,所以B为![]() ,D为
,D为![]() 。B转化为F是发生了消去反应,F利用分子中的碳碳双键发生加聚反应生成高分子化合物G。
。B转化为F是发生了消去反应,F利用分子中的碳碳双键发生加聚反应生成高分子化合物G。
(1)B为![]() ,可以和氢卤酸、羧酸等发生取代反应,可以在浓硫酸作用下发生消去反应,可以被氧气、酸性高锰酸钾溶液氧化,B没有不饱和键,不能发生加聚反应,故选①②④;
,可以和氢卤酸、羧酸等发生取代反应,可以在浓硫酸作用下发生消去反应,可以被氧气、酸性高锰酸钾溶液氧化,B没有不饱和键,不能发生加聚反应,故选①②④;
(2)D为![]() ,分子所含有的官能团是羧基;
,分子所含有的官能团是羧基;
(3)与D、E具有相同官能团的有机物还可能为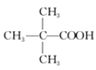 或CH3CH2CH2CH2COOH;
或CH3CH2CH2CH2COOH;
(4)B+E→A发生了酸和醇的酯化反应,化学方程式为:
![]() +H2O;
+H2O;
B→C发生的是醇的催化氧化,醇被氧化成醛,化学方程式为:![]() +O2
+O2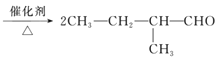 +2H2O;
+2H2O;
F→G发生的是烯烃的加聚反应,化学方程式为:n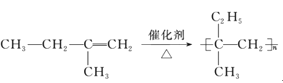 。
。


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列判断正确的是( )
A.28gN2含有的氮原子数目为NA
B.常温常压下,22.4 L Cl2含有的分子数目为 NA
C.1mol/LK2CO3溶液中含有的钾离子数目为NA
D.在标准状况下,22.4LCO和N2的混合物的物质的量为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图:______________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式:__________________________。
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1;H2(g)+
H2(g)+2O2(g)=H3AsO4(s) ΔH1;H2(g)+![]() O2(g)=H2O(l) ΔH2;2As(s)+
O2(g)=H2O(l) ΔH2;2As(s)+![]() O2(g)=As2O5(s) ΔH3。则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的ΔH=________________________。
O2(g)=As2O5(s) ΔH3。则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的ΔH=________________________。
(4)298 K时,将20mL 3x mol·L-1Na2AsO3、20mL 3x mol·L-1 I2和20mL NaOH溶液混合,发生反应:AsO33- (aq)+I2(aq)+2OH-(aq)=AsO43- (aq)+2I-(aq)+H2O(l)。溶液中c(AsO43- )与反应时间(t)的关系如图所示。
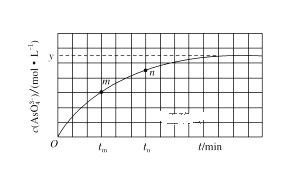
①下列可判断反应达到平衡的是________(填选项字母)。
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.![]() 不再变化 d.c(I-)=y mol·L-1
不再变化 d.c(I-)=y mol·L-1
②tm时,v正______v逆(填“大于”“小于”或“等于”)。
③tm时的v逆____tn时的v逆(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)S2-的结构示意图为__________;7 g 35Cl2所含的中子数为________。
(2)下列物质中,能导电的有____________;属于电解质的是_________。
①石墨②CO2 ③液态HCl ④Na2CO3固体 ⑤熔融Al2O3 ⑥葡萄糖 ⑦KOH溶液
(3)工业上电解饱和食盐水制氯气的化学方程式为_____________,用双线桥表示其电子转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等浓度的H2SO4、NaHSO4溶液,分别滴入两份相同的Ba(OH)2溶液中,其电导率与滴入溶液体积变化的曲线如图所示。下列分析正确的是( )
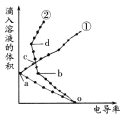
A.b→d反应的离子方程式为:H++OH-=H2O
B.d点溶液中,Na+与SO42-的物质的量之比为1:1
C.c点导电能力相同,所以两溶液中含有相同量的OH-
D.a、b两点Ba2+均沉淀完全,所以对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“共生系统”能很大程度上提高经济效益。研究硫酸工业尾气的“共生系统”具有重要意义。回答下列问题:
(1)工业上,将Na2CO3和Na2S以合适的物质的量比配成溶液,吸收富集的SO2,可制取重要的化工原料Na2S2O3,同时放出CO2。该反应的化学方程式为___________________。
(2)工业上,将富含SO2的工业尾气降温液化,收集液态SO2。用液态SO2、硫磺(用S表示)、液氯为原料,在200℃~250℃活性炭催化条件下合成氯化剂SOCl2。该反应中氧化剂与还原剂的物质的量之比为________________。
(3)SOCl2分子的空间构型为______________。下列关于O、S、Se三种同主族元素的叙述正确的是____________(填序号)。
a.沸点:H2O>H2S>H2Se
b.H2O分子中H—O—H键的键角小于H2S分子中H—S—H键的键角
c.热稳定性H2O>H2S>H2Se
d.CS2是一种直线型分子,分子中C、S原子都满足8电子稳定结构
(4)氯化亚砜(SOCl2,易挥发液体,易水解)常用作脱水剂。ZnCl2·xH2O制取无水ZnCl2流程如图所示:
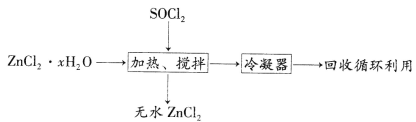
①利用SOCl2和ZnCl2·xH2O混合加热可制得无水ZnCl2的原因是_________________________________(用化学方程式和必要的文字解释)。
②甲同学认为SOCl2也可用于FeCl3·6H2O制取无水FeCl3,但乙同学认为该过程会发生氧化还原反应。要验证乙同学观点是否正确,可选择下列试剂中的___________(填序号)。
a.K3[Fe(CN)6]溶液 b.BaCl2溶液和稀盐酸
c.AgNO3溶液和稀硝酸 d.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的两种元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)X与L形成的常见阴离子的电子式为____________________。
(2)Z、X两元素按原子数目比1:3和2:4构成分子A和B,用电子式表示A的形成过程______,B的结构式_______________________。
(3)硒是人体必须的微量元素,与L同一主族,硒原子比L原子多两个电子层,则硒在周期表的位置为_______________,其最高价氧化物水化物的化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为___,该能层具有的原子轨道数为___。
(2)BF3与一定量的水形成(H2O)2BF3晶体Q,Q在一定条件下可转化为R:

晶体Q中各种微粒间的作用力有______(填序号)。
a.离子键 b.共价键 c.配位键 d.氢键
(3)第一电离能I1(Zn)___I1(Cu)(填“大于”或“小于”),原因是______。
(4)Ti晶体的原子堆积方式为六方堆积(如图所示),则晶体中Ti原子的配位数是___,某Ti配合物的化学式是[Ti (H2O)5Cl]Cl2·H2O,1 mol该配合物中含配位键的数目是___。
![]()
(5)石墨烯(如图a)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图b)。
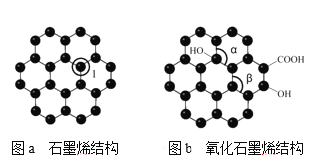
图a中,1号C与相邻C形成σ键的个数为____,图b中键角α___键角β。(填“>”、“<”或“=” );若将图b所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有_____(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):
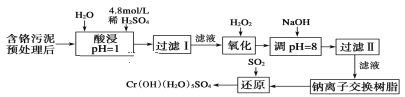
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | - | - | 4.7 | - |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是___(写一条即可)。
(2)调pH=8是为了除去___(填Fe3+、Al3+、Ca2+、Mg2+)。
(3)试配平氧化还原反应方程式:_Na2Cr2O7+_SO2+_H2O=________Cr(OH)(H2O)5SO4+_Na2SO4;每生成1molCr(OH)(H2O)5SO4消耗SO2的物质的量为___。
(4)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+ 和Fe2+的实验步骤:①___;②___;③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com