
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图:______________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式:__________________________。
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1;H2(g)+
H2(g)+2O2(g)=H3AsO4(s) ΔH1;H2(g)+![]() O2(g)=H2O(l) ΔH2;2As(s)+
O2(g)=H2O(l) ΔH2;2As(s)+![]() O2(g)=As2O5(s) ΔH3。则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的ΔH=________________________。
O2(g)=As2O5(s) ΔH3。则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的ΔH=________________________。
(4)298 K时,将20mL 3x mol·L-1Na2AsO3、20mL 3x mol·L-1 I2和20mL NaOH溶液混合,发生反应:AsO33- (aq)+I2(aq)+2OH-(aq)=AsO43- (aq)+2I-(aq)+H2O(l)。溶液中c(AsO43- )与反应时间(t)的关系如图所示。
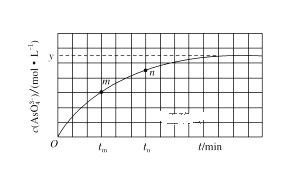
①下列可判断反应达到平衡的是________(填选项字母)。
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.![]() 不再变化 d.c(I-)=y mol·L-1
不再变化 d.c(I-)=y mol·L-1
②tm时,v正______v逆(填“大于”“小于”或“等于”)。
③tm时的v逆____tn时的v逆(填“大于”“小于”或“等于”)。
【答案】 2As2S3+5O2+6H2O=4H3AsO4+6S 2ΔH1-3ΔH2-ΔH3 ac 大于 小于
2As2S3+5O2+6H2O=4H3AsO4+6S 2ΔH1-3ΔH2-ΔH3 ac 大于 小于
【解析】
由已知热化学方程式的热焓变求未知反应的热焓变时,可利用盖斯定律进行计算。
在利用坐标图象进行正逆反应速率的比较时,可利用曲线的走势,判断反应是正向进行还是达平衡状态,从而得出正、逆反应速率或逆、逆反应速率的大小关系。
(1)砷的原子结构示意图: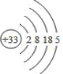 ;
;
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。发生反应的化学方程式:2As2S3+5O2+6H2O===4H3AsO4+6S;
(3)已知:As(s)+![]() H2(g)+2O2(g)===H3AsO4(s) ΔH1 ①
H2(g)+2O2(g)===H3AsO4(s) ΔH1 ①
H2(g)+![]() O2(g)===H2O(l) ΔH2 ②
O2(g)===H2O(l) ΔH2 ②
2As(s)+![]() O2(g)===As2O5(s) ΔH3 ③
O2(g)===As2O5(s) ΔH3 ③
将①×2-②×3-③得:As2O5(s)+3H2O(l)===2H3AsO4(s)的ΔH=2ΔH1-3ΔH2-ΔH3;
(4)①a.溶液的pH不再变化,说明c(OH-)不变,反应达平衡状态,a符合题意;
b.v(I-)=2v(AsO33-),说明未达平衡状态,因为平衡状态时各物质表示的平均反应速率都为0,b不合题意;
c.![]() 不再变化,说明AsO33- 、AsO43- 的浓度保持不变,反应达平衡状态,c符合题意;
不再变化,说明AsO33- 、AsO43- 的浓度保持不变,反应达平衡状态,c符合题意;
d.c(I-)=y mol·L-1,因为达平衡状态时,c(I-)=2y mol·L-1,所以反应未达平衡状态,d不合题意;
故选ac;
②tm时,反应正向进行,所以v正大于v逆。答案为:大于;
③因为从tm到tn,反应仍在正向进行,而随着反应的不断进行,逆反应速率不断增大,所以tm时v逆小于tn时v逆。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】将4.6gNa和2.7gAl同时加入到足量的水中充分反应,将反应后的溶液稀释定容为500mL。下列说法不正确的是
A.所得溶液中阳离子和阴离子的物质的量之比为1∶1
B.反应中消耗的水的质量是加入的Al的质量的2倍
C.所得溶液中AlO2-的物质的量浓度为0.2mol/L
D.反应中放出的气体在标准状况下的体积为2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是
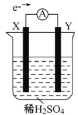 .
.
A. 外电路的电流方向为:X→导线→Y
B. 若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C. X极上发生的是还原反应,Y极上发生的是氧化反应
D. 若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(22Ti)由于其特殊的性能被誉为“未来世纪的金属”。钛铁矿主要成分为FeTiO3(含有少量MgO、SiO2等杂质),Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿来制备,工艺流程如下:
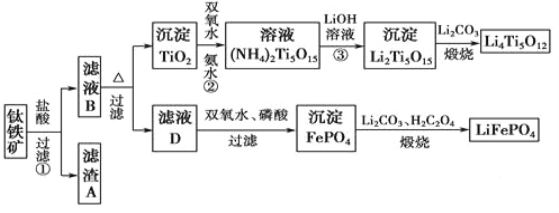
(1)Ti位于元素周期表中的位置为________。钛铁矿在预处理时需要进行粉碎,其原因是_______。
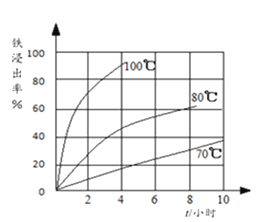
(2)过程①中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为80%时,所采用的实验条件是_________。
(3)过程②中固体TiO2与双氧水、氨水反应转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示,反应温度过高时,Ti元素浸出率下降的原因是___________。

(4)写出由滤液D生成FePO4的离子方程式____________________________________。
(5)由流程图可知FePO4制备LiFePO4的化学方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
(1)写出下列物质在水溶液中的电离方程式:
①Ba(OH)2:__________; ②NaHSO4__________
③写出①②水溶液混合后恰好沉淀完全的离子方程式______________
(2)相同物质的量的O2和O3的质量比__________,分子个数比为 __________,所含氧原子的个数比为__________
(3)下列各组物质的分离或提纯,应选用下述方法的哪一种?(填选项字母)
A 分液 B 过滤 C 萃取 D 蒸馏 E 蒸发结晶 F 高温分解
①分离CCl4和H2O__________;
②除去澄清石灰水中悬浮的CaCO3:__________;
③除去CaO固体中少量的CaCO3固体__________;
④从碘水中提取碘__________;
⑤分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物:__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图:A处通入氯气,关闭B时,C中红色布条颜色无变化;当打开B时,C处红色布条颜色褪去。则相关判断正确的是
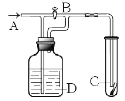
A.通入的Cl2含有水蒸气B.D中不可能是浓H2SO4
C.D中可能是水D.D中可能是饱和食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列各组物质:
①O2和O3 ②CH2=CH﹣CH3和CH2=CH﹣CH=CH2 ③ 和
和
④![]() 和
和![]() ⑤CH3CH2CH3和CH3C(CH3)3
⑤CH3CH2CH3和CH3C(CH3)3
⑥![]() 和质量数为238中子数为146的原子 ⑦CH3COOH与HCOOCH3
和质量数为238中子数为146的原子 ⑦CH3COOH与HCOOCH3
按要求用序号填空
属于同系物的是________ 属于同分异构体的是_____属于同种物质的是________
(2)下列反应中,属于吸热反应的是__________.
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳
⑤食物因氧化而腐败 ⑥Ba(OH)2·8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应.
(3)现有:①干冰 ②金刚石 ③NH4Cl ④Na2S四种物质,按下列要求回答(填序号):熔化时不需要破坏化学键的是____________;既存在离子键又存在共价键的是____________。
(4)已知:2H2(g)+O2(g)=2H2O(g) △H=-483 kJ·mol -1N2(g)+2O2(g)=2NO2(g) △H=+68kJ·mol -1则H2还原NO2生成水蒸气的热化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)如表是A、B两种有机物的有关信息:
A | B |
①分子模型为: ②能使溴的四氯化碳溶液褪色; ③其产量是衡量石油化工水平的标志。 | ①由C、H、O三种元素组成,是厨房中的常见调味剂; ②水溶液能使紫色石蕊试液变红。 |
根据表中信息回答下列问题:
(1)关于A的下列说法中,不正确的是_____(填标号)。
a.分子里含有碳碳双键 b.分子里所有的原子共平面 c.结构简式为CH2-CH2
(2)A与H2发生加成反应后生成X,与X在分子组成和结构上相似的有机物有一大类,它们的通式为CnH2n+2。当n=___时,这类机物开始出现同分异构休。
(Ⅱ)已知有机物A~F有如图转化关系:
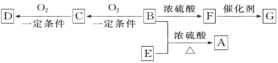
已知:①2CH3CHO+O2![]() 2CH3COOH+2H2O;
2CH3COOH+2H2O;
②CH3CH2OH![]() CH2=CH2↑+H2O(该反应属于消去反应)。
CH2=CH2↑+H2O(该反应属于消去反应)。
③A的分子式为C10H20O2; ④B分子中含2个甲基;⑤D、E互为具有相同官能团的同分异构体,D能与碳酸氢钠反应放出CO2,E分子烃基上的氢原子若被Cl取代,其一氯代物有3种;⑥F可以使溴的四氯化碳溶液褪色,G为高分子化合物。请填写以下空白:
(1)B可以发生的反应有_____(填序号)。
①取代反应 ②消去反应 ③加聚反应 ④氧化反应
(2)D分子所含有的官能团的名称是________。
(3)写出与D、E具有相同官能团的同分异构体(D、E除外)可能的结构简式______。
(4)写出下列转化的化学方程式:
B+E→A:_______;
B→C:___________;
F→G:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH+NH4++HCO3=BaCO3↓+NH3·H2O+H2O
B.将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O
C.用铁电极电解氯化钠溶液:2Cl+2H2O![]() 2OH+H2↑+Cl2↑
2OH+H2↑+Cl2↑
D.将SO2通入Ca(ClO)2溶液中:Ca2++2ClO+SO2+H2O=CaSO3↓+2HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com