
【题目】钛(22Ti)由于其特殊的性能被誉为“未来世纪的金属”。钛铁矿主要成分为FeTiO3(含有少量MgO、SiO2等杂质),Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿来制备,工艺流程如下:
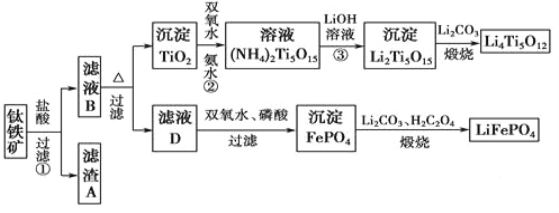
(1)Ti位于元素周期表中的位置为________。钛铁矿在预处理时需要进行粉碎,其原因是_______。
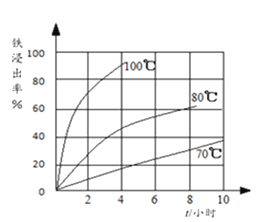
(2)过程①中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为80%时,所采用的实验条件是_________。
(3)过程②中固体TiO2与双氧水、氨水反应转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示,反应温度过高时,Ti元素浸出率下降的原因是___________。

(4)写出由滤液D生成FePO4的离子方程式____________________________________。
(5)由流程图可知FePO4制备LiFePO4的化学方程式是_________________________。
【答案】第四周期IVB增大反应物接触面积,加快反应速率100℃ 3小时温度过高,双氧水分解与氨气逸出导致Ti元素浸出率下降2Fe2++ H2O2+ 2H3PO4 == 2FePO4 + 4H++ 2H2O2FePO4+ Li2CO3+ H2C2O4![]() 2LiFePO4+ 3CO2↑+ H2O
2LiFePO4+ 3CO2↑+ H2O
【解析】
(1)Ti的原子序数为22,处于第四周期第ⅣB族。钛铁矿在预处理时进行粉碎,增大了与盐酸的接触面积,可以加快反应速率。
(2)由图中三条曲线可得,当铁的浸出率为80%时,应为100℃、约浸取3小时。
(3)由于二氧化钛与氨水、双氧水反应生成(NH4)2Ti5O15时,温度过高,双氧水和氨水都容易分解(双氧水分解与氨气逸出),所以反应温度过高时,Ti元素浸出率下降。
(4)由流程可得,滤液D含有Fe2+,与H2O2、H3PO4反应,生成FePO4,离子方程式为:2Fe2++H2O2+2H3PO4=2FePO4+ 4H++2H2O。
(5)由流程图可知FePO4与H2C2O4、Li2CO3高温煅烧发生反应生成LiFePO4,铁的化合价降低,FePO4应为氧化剂,所以H2C2O4应为还原剂,故化学方程式为:2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+3CO2↑+H2O。
2LiFePO4+3CO2↑+H2O。


科目:高中化学 来源: 题型:
【题目】2017年3月21日是第二十五届“世界水日”,保护水资源,合理利用废水节省水资源,加强废水的回收利用已被越来越多的人所关注。已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3—、CO32—、SO42—中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作和有关图像如下所示:

请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的阴离子是_________________,一定存在的阳离子是__________________________。
(2)写出实验③图像中沉淀开始减少至完全消失阶段发生反应的离子反应方程式:__________________。
(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为______________________,所得沉淀的最大质量是_____________________g。
(4)若通过实验确定原废水中c(Na+)=0.14 mol·L1,试判断原废水中NO3是否存在?_______(填“存在”“不存在”或“不确定”)。 若存在,c(NO3)=___________mol·L1。(若不存在或不确定则此空不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列判断正确的是( )
A.28gN2含有的氮原子数目为NA
B.常温常压下,22.4 L Cl2含有的分子数目为 NA
C.1mol/LK2CO3溶液中含有的钾离子数目为NA
D.在标准状况下,22.4LCO和N2的混合物的物质的量为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某学校实验室买回的硫酸试剂标签的部分内容。判断下列说法正确的是( )

A. 该硫酸的浓度为9.2 mol·L-1
B. 配制480 mL 4.6 mol·L-1的稀硫酸需该H2SO4125mL
C. 该硫酸与等体积水混合质量分数变为49%
D. 取该硫酸100 mL,则浓度变为原来的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。在催化剂的作用下,利用合成气(主要成分为CO、CO2和H2)合成甲醇的主要化学反应如下:
Ⅰ.CO+2H2CH3OH
Ⅱ.CO2+3H2CH3OH+H2O
Ⅲ.CO2+H2CO+H2O
请回答下列问题:
(1)已知三种物质的标准燃烧热如下表:
物质 | CO(g) | H2(g) | CH3OH(l) |
燃烧热(kJ·mol1) | 283.0 | 285.8 | 726.51 |
①书写25℃、101kPa条件时CO燃烧热的热化学方程式______________________。
②计算25℃、101kPa条件时反应Ⅰ的ΔH=_____kJ·mol1 。
(2)甲醇燃料电池(Direct Methanol Fuel Cell)属于质子交换膜燃料电池,其工作原理如图所示:
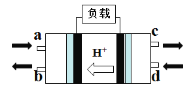
①c处产生的气体是________。
②负极的电极反应式是____________。
(3)下图是甲醇燃料电池工作示意图,其中A,B,D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A,B两极上产生的气体体积相同。
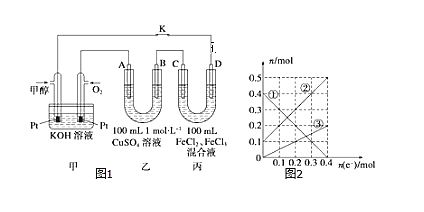
①乙中B极的电极反应式_______。
②乙中A极析出的气体在标况下的体积________。
③丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,则②线表示的是____的变化,反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要____mL 5mol/LNaOH溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。从工业废水中回收硫酸亚铁和金属铜的工艺流程如图所示。
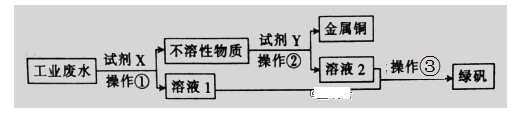
(1)操作③的名称为__________ 。
(2)试剂X为__________(填化学式),操作②涉及的离子反应方程式为__________ 。
Ⅱ.(3)研究表明:多种海产品如虾、蟹、牡蛎等,体内含有+5 价砷(As)元素,但它对人体是无毒的,砒霜的成分是 As2O3,属剧毒物质,专家忠告:吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:大量海鲜+大量维生素 C=砒霜。该使人中毒过程中维生素 C 是________(填“氧化剂”或“还原剂)
(4)已知某反应中反应物和生成物有:KMnO4、H2SO4、MnSO4、H2C2O4、K2SO4、H2O和一种未知物X。
①若0.5 molH2C2O4在反应中失去1 mol电子生成X,则X的化学式为__________ 。
②将氧化剂和还原剂及配平的系数填入下列方框中,并用单线桥标出电子转移的方向和 数目。__________
![]()
③若已知H2C2O4为弱酸,试写出该反应的离子方程式:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图:______________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式:__________________________。
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1;H2(g)+
H2(g)+2O2(g)=H3AsO4(s) ΔH1;H2(g)+![]() O2(g)=H2O(l) ΔH2;2As(s)+
O2(g)=H2O(l) ΔH2;2As(s)+![]() O2(g)=As2O5(s) ΔH3。则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的ΔH=________________________。
O2(g)=As2O5(s) ΔH3。则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的ΔH=________________________。
(4)298 K时,将20mL 3x mol·L-1Na2AsO3、20mL 3x mol·L-1 I2和20mL NaOH溶液混合,发生反应:AsO33- (aq)+I2(aq)+2OH-(aq)=AsO43- (aq)+2I-(aq)+H2O(l)。溶液中c(AsO43- )与反应时间(t)的关系如图所示。
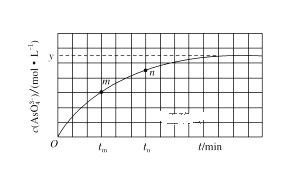
①下列可判断反应达到平衡的是________(填选项字母)。
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.![]() 不再变化 d.c(I-)=y mol·L-1
不再变化 d.c(I-)=y mol·L-1
②tm时,v正______v逆(填“大于”“小于”或“等于”)。
③tm时的v逆____tn时的v逆(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)S2-的结构示意图为__________;7 g 35Cl2所含的中子数为________。
(2)下列物质中,能导电的有____________;属于电解质的是_________。
①石墨②CO2 ③液态HCl ④Na2CO3固体 ⑤熔融Al2O3 ⑥葡萄糖 ⑦KOH溶液
(3)工业上电解饱和食盐水制氯气的化学方程式为_____________,用双线桥表示其电子转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为___,该能层具有的原子轨道数为___。
(2)BF3与一定量的水形成(H2O)2BF3晶体Q,Q在一定条件下可转化为R:

晶体Q中各种微粒间的作用力有______(填序号)。
a.离子键 b.共价键 c.配位键 d.氢键
(3)第一电离能I1(Zn)___I1(Cu)(填“大于”或“小于”),原因是______。
(4)Ti晶体的原子堆积方式为六方堆积(如图所示),则晶体中Ti原子的配位数是___,某Ti配合物的化学式是[Ti (H2O)5Cl]Cl2·H2O,1 mol该配合物中含配位键的数目是___。
![]()
(5)石墨烯(如图a)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图b)。
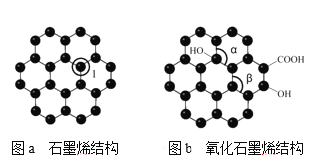
图a中,1号C与相邻C形成σ键的个数为____,图b中键角α___键角β。(填“>”、“<”或“=” );若将图b所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有_____(填元素符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com