
【题目】甲醇是重要的化工原料。在催化剂的作用下,利用合成气(主要成分为CO、CO2和H2)合成甲醇的主要化学反应如下:
Ⅰ.CO+2H2CH3OH
Ⅱ.CO2+3H2CH3OH+H2O
Ⅲ.CO2+H2CO+H2O
请回答下列问题:
(1)已知三种物质的标准燃烧热如下表:
物质 | CO(g) | H2(g) | CH3OH(l) |
燃烧热(kJ·mol1) | 283.0 | 285.8 | 726.51 |
①书写25℃、101kPa条件时CO燃烧热的热化学方程式______________________。
②计算25℃、101kPa条件时反应Ⅰ的ΔH=_____kJ·mol1 。
(2)甲醇燃料电池(Direct Methanol Fuel Cell)属于质子交换膜燃料电池,其工作原理如图所示:
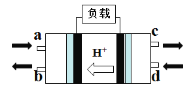
①c处产生的气体是________。
②负极的电极反应式是____________。
(3)下图是甲醇燃料电池工作示意图,其中A,B,D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A,B两极上产生的气体体积相同。
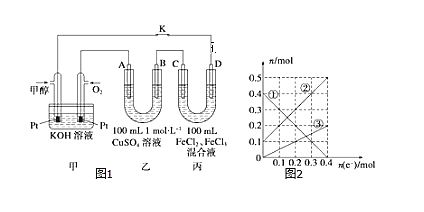
①乙中B极的电极反应式_______。
②乙中A极析出的气体在标况下的体积________。
③丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,则②线表示的是____的变化,反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要____mL 5mol/LNaOH溶液。
【答案】CO (g)+![]() O2(g)= CO2(g) △H= -283.0 kJmol-1 -128.09 CO2 CH3OH+H2O-6e-=CO2↑+6H+ Cu2+ +2e-=Cu 2H++2e-=H2↑ 2.24L Fe2+ 280ml
O2(g)= CO2(g) △H= -283.0 kJmol-1 -128.09 CO2 CH3OH+H2O-6e-=CO2↑+6H+ Cu2+ +2e-=Cu 2H++2e-=H2↑ 2.24L Fe2+ 280ml
【解析】
判断燃料电池的电极产物及书写电极反应式时,解题的切入点是H+的迁移方向,由H+的迁移方向,结合电极反应式,可确定电池的正、负极,也就确定了左、右电极发生的反应。
(1)① CO燃烧热的热化学方程式CO (g)+![]() O2(g)= CO2(g) △H= -283.0 kJmol-1;
O2(g)= CO2(g) △H= -283.0 kJmol-1;
② CO (g)+![]() O2(g)= CO2(g) △H= -283.0 kJmol-1 a
O2(g)= CO2(g) △H= -283.0 kJmol-1 a
H2(g)+![]() O2(g)= H2O(g) △H= -285.8 kJmol-1 b
O2(g)= H2O(g) △H= -285.8 kJmol-1 b
CH3OH(l)+![]() O2(g)= CO2(g)+2H2O(l) △H= -726.51 kJmol-1 c
O2(g)= CO2(g)+2H2O(l) △H= -726.51 kJmol-1 c
将a+2b-c得 CO(g)+2H2(g)CH3OH(l) △H= -128.09 kJmol-1;
(2)甲醇燃料电池的正极反应式为:O2+4e-+4H+=2H2O,负极反应式为:CH3OH+H2O-6e-=CO2↑+6H+;由H+的迁移方向,我们可推知左侧电极为正极,右侧电极为负极;
①c处产生的气体是CO2;
②负极的电极反应式是CH3OH+H2O-6e-=CO2↑+6H+;
(3)在甲池中,通甲醇的电极为负极,通O2的电极为正极,则A、C为阳极,B、D为阴极;
①乙中B极,首先是溶液中的Cu2+得电子生成Cu,然后是H+得电子生成H2,电极反应式为Cu2+ +2e-=Cu、2H++2e-=H2↑;
②乙中B极发生的反应为:Cu2+ + 2e- = Cu、2H+ + 2e- = H2↑
0.1mol 0.2mol 0.2mol 0.2mol
A极发生的反应为2H2O+4e-=4H++O2↑,
0.4mol 0.1mol
按两电极得失电子的数目相等进行计算,线路中转移的电子应为0.4mol,生成气体0.1mol,析出的气体在标况下的体积2.24L;
③丙装置溶液中,发生的反应为2Fe3++2e-=2Fe2+ Cu-2e-=Cu2+
对照图中线段的变化,可确定①为Fe3+、②为Fe2+、③为Cu2+,则②线表示的是Fe2+的变化;反应结束后,要使丙装置中金属阳离子Fe2+(0.5mol)、Cu2+(0.2mol)恰好完全沉淀,则需NaOH的物质的量为:0.5mol×2+0.2mol×2=1.4mol,V(NaOH)=![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】甲醇可作为燃料电池的原料。CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,
(1)已知在常温常压下:
①CH3OH(l)+ O2(g)=CO(g) + 2H2O(g); ΔH=﹣355.0 kJ∕mol
②2CO(g)+ O2(g)= 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式:___________________________
(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)=CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是__________
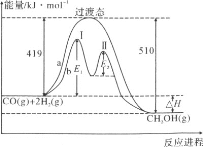
A.上述反应的ΔH=-91kJ·mol-1
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(3)下列是科研小组设计的一个甲醇燃料电池,两边的阴影部分为a,b惰性电极,分别用导线与烧杯的m,n相连接,工作原理示意图如图:
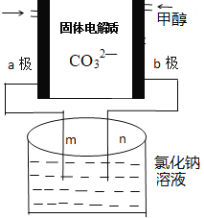
①b极电极反应式为____________。
②在标准状况下,若通入112mL的O2,(假设烧杯中的溶液的体积为200mL,体积不变)最后反应终止时烧杯中溶液的pH为______。
(4)可利用CO2根据电化学原理制备塑料,既减少工业生产对乙烯的依赖,又达到减少CO2排放的目的。以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2进行电解,在阴极可制得低密度聚乙烯![]() (简称LDPE)。
(简称LDPE)。
①电解时,阴极的电极反应式是________。
②工业上生产1.4×102kg的LDPE,理论上需要标准状况下________L的CO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
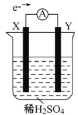
【题目】如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是
 .
.
A. 外电路的电流方向为:X→导线→Y
B. 若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C. X极上发生的是还原反应,Y极上发生的是氧化反应
D. 若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图,下列有关该电池的说法正确的是( )
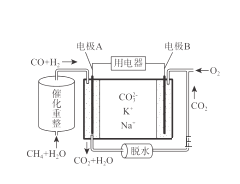
A. 反应CH4+3H2O 3H2+CO消耗1mol CH4转移4mol电子
3H2+CO消耗1mol CH4转移4mol电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(22Ti)由于其特殊的性能被誉为“未来世纪的金属”。钛铁矿主要成分为FeTiO3(含有少量MgO、SiO2等杂质),Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿来制备,工艺流程如下:
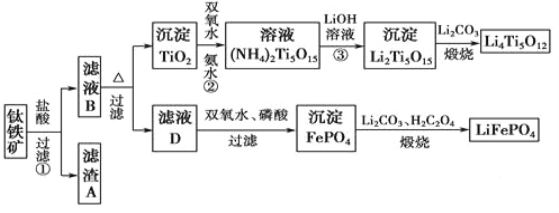
(1)Ti位于元素周期表中的位置为________。钛铁矿在预处理时需要进行粉碎,其原因是_______。
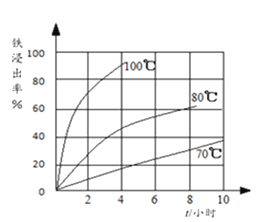
(2)过程①中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为80%时,所采用的实验条件是_________。
(3)过程②中固体TiO2与双氧水、氨水反应转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示,反应温度过高时,Ti元素浸出率下降的原因是___________。

(4)写出由滤液D生成FePO4的离子方程式____________________________________。
(5)由流程图可知FePO4制备LiFePO4的化学方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
(1)写出下列物质在水溶液中的电离方程式:
①Ba(OH)2:__________; ②NaHSO4__________
③写出①②水溶液混合后恰好沉淀完全的离子方程式______________
(2)相同物质的量的O2和O3的质量比__________,分子个数比为 __________,所含氧原子的个数比为__________
(3)下列各组物质的分离或提纯,应选用下述方法的哪一种?(填选项字母)
A 分液 B 过滤 C 萃取 D 蒸馏 E 蒸发结晶 F 高温分解
①分离CCl4和H2O__________;
②除去澄清石灰水中悬浮的CaCO3:__________;
③除去CaO固体中少量的CaCO3固体__________;
④从碘水中提取碘__________;
⑤分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物:__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列各组物质:
①O2和O3 ②CH2=CH﹣CH3和CH2=CH﹣CH=CH2 ③ 和
和
④![]() 和
和![]() ⑤CH3CH2CH3和CH3C(CH3)3
⑤CH3CH2CH3和CH3C(CH3)3
⑥![]() 和质量数为238中子数为146的原子 ⑦CH3COOH与HCOOCH3
和质量数为238中子数为146的原子 ⑦CH3COOH与HCOOCH3
按要求用序号填空
属于同系物的是________ 属于同分异构体的是_____属于同种物质的是________
(2)下列反应中,属于吸热反应的是__________.
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳
⑤食物因氧化而腐败 ⑥Ba(OH)2·8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应.
(3)现有:①干冰 ②金刚石 ③NH4Cl ④Na2S四种物质,按下列要求回答(填序号):熔化时不需要破坏化学键的是____________;既存在离子键又存在共价键的是____________。
(4)已知:2H2(g)+O2(g)=2H2O(g) △H=-483 kJ·mol -1N2(g)+2O2(g)=2NO2(g) △H=+68kJ·mol -1则H2还原NO2生成水蒸气的热化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.如图是一套制取并验证氯气部分化学性质的实验装置(装置A制取氯气)。
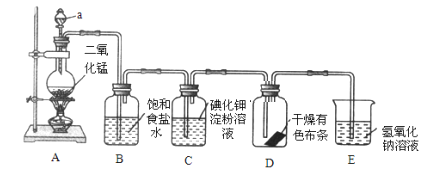
回答下列问题:
(1)当Cl2持续通过时,装置D中干燥的有色布条能否褪色?为什么?__,__。
(2)若要证明干燥的Cl2无漂白性,可在装置D前添加一个装有__的洗气瓶。
(3)装置E的作用是___,该反应的离子方程式为__。
II.欲用98%的浓硫酸(密度为1.84g·cm-3)配制成浓度为0.5mol·L-1的稀硫酸500mL。
(4)所需浓硫酸的体积为___mL。
(5)选用的主要仪器有:烧杯、量筒、胶头滴管、玻璃棒和___。
(6)操作正确的顺序为___(填序号)。
A.用量筒量取浓硫酸 B.反复颠倒摇匀 C.用胶头滴管加水至刻度 D.将配制好的溶液转入试剂瓶中贴上标签 E.稀释浓硫酸 F.将溶液转入容量瓶
(7)在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度___0.5mol·L-1(填“大于”“小于”或“等于”)。
(8)该同学在定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响__(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com