
【题目】下列反应既是化合反应,又是氧化还原反应的是
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
【答案】A
【解析】
根据化合反应是指由两种或两种以上物质反应只生成一种物质的反应;氧化还原反应是化合价变化的反应。
A.C+CO2![]() 2CO是化合反应,反应中碳元素和氧元素的化合价发生了变化,是氧化还原反应,故A正确;
2CO是化合反应,反应中碳元素和氧元素的化合价发生了变化,是氧化还原反应,故A正确;
B.CaO+H2O=Ca(OH)2是化合反应,反应中各元素的化合价未发生变化,不属于氧化还原反应,故B错误;
C.C+H2O![]() CO+H2属于置换反应不属于化合反应,反应中C和H的化合价在反应前后发生变化,属于氧化还原反应,故C错误;
CO+H2属于置换反应不属于化合反应,反应中C和H的化合价在反应前后发生变化,属于氧化还原反应,故C错误;
D.CO2+Ca(OH)2=CaCO3↓+H2O属于复分解反应不属于化合反应,反应中反应前后各元素的化合价都没有发生变化,不属于氧化还原反应,故D错误;
答案:A


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】某固体A在空气中点燃,火焰呈黄色,并生成淡黄色固体B;将A在空气中露置,最后变成白色固体C。将A、B投入水中都生成D;B、C、D在一定条件下均能与二氧化碳反应。
(1)A是___;B是___;C是___;D是___。(填化学符号)
(2)完成下列方程式:
B与H2O反应的化学方程___。
向C的稀溶液中通入CO2的离子方程式____。
A与H2O反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近来查明二氧化三碳(![]() )是金星大气层的一个组成部分,下列关于
)是金星大气层的一个组成部分,下列关于![]() 说法不正确的是 ( )
说法不正确的是 ( )
A. 结构式可能为:![]() B.
B. ![]() 、CO、
、CO、![]() 都是碳的氧化物
都是碳的氧化物
C. ![]() 不属于酸性氧化物D.
不属于酸性氧化物D. ![]() 、CO都可以燃烧生成
、CO都可以燃烧生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).下列说法错误的是( )
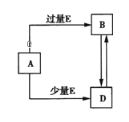
A. A、B、D可能是钠及其化合物 B. A、B、D可能是镁及其化合物
C. A、B、D可能是铝及其化合物 D. A、B、D可能是非金属及其化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
I.已知某些化学键的键能数据如下
化学键 | C=O | C—O | C—H | H—H | O—H |
键能/kJ·mol-1 | 745 | 351 | 415 | 436 | 462 |
则CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ΔH = __________ kJ·mol-1
CH3OH(g) + H2O(g) ΔH = __________ kJ·mol-1
II.将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g)![]() CH3OCH3(g) + 3H2O(l)
CH3OCH3(g) + 3H2O(l)
(1)该反应化学平衡常数表达式K = __________。
(2)已知在某压强下,该反应在不同温度、不同投料比时,达平衡时CO2的转化率如图所示:

①该反应的ΔH __________ 0(填“>"或“<”)。
②若温度不变,减小反应投料比[n(H2)/n(CO2)],K值将____(填“增大”、“减小”或“不变”)。
(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,下列物理量不再发生变化时,能说明反应达到平衡状态的是__________。
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
(4)某温度下,在体积可变的密闭容器中,改变起始时加入各物质的量,在不同的压强下,平衡时CH3OCH3(g)的物质的量如下表所示:
P1 | P2 | P3 | |
I.2.0 mol CO2 6.0 mol H2 | 0.10 mol | 0.04 mol | 0.02 mol |
II.1.0 mol CO22 | X1 | Y1 | Z1 |
III.1.0 mol CH3OCH3 3.0 mol H2O | X2 | Y2 | Z2 |
①P1 __________ P3(填“>”“<”或“=”);
②P2下,III中CH3OCH3的平衡转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列判断正确的是( )
A.28gN2含有的氮原子数目为NA
B.常温常压下,22.4 L Cl2含有的分子数目为 NA
C.1mol/LK2CO3溶液中含有的钾离子数目为NA
D.在标准状况下,22.4LCO和N2的混合物的物质的量为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究硫酸亚铁的分解产物,进行了如下图装置所示的实验,打开K1和K2,缓缓通入N2,一段时间后加热,实验后反应管中残留固体为红色粉末,BaCl2溶液中有白色沉淀产生,品红溶液中红色褪去,检查氢氧化钠溶液出口处无氧气产生。下列说法错误的是

A. 氢氧化钠溶液的作用是吸收多余的SO2气体
B. 反应管内产生的红色粉末可能是Fe2O3
C. BaCl2溶液的目的是检验SO3的存在,此处用Ba(NO3)2溶液也可以检验SO3
D. 反应管内得到的氧化产物和还原产物物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。在催化剂的作用下,利用合成气(主要成分为CO、CO2和H2)合成甲醇的主要化学反应如下:
Ⅰ.CO+2H2CH3OH
Ⅱ.CO2+3H2CH3OH+H2O
Ⅲ.CO2+H2CO+H2O
请回答下列问题:
(1)已知三种物质的标准燃烧热如下表:
物质 | CO(g) | H2(g) | CH3OH(l) |
燃烧热(kJ·mol1) | 283.0 | 285.8 | 726.51 |
①书写25℃、101kPa条件时CO燃烧热的热化学方程式______________________。
②计算25℃、101kPa条件时反应Ⅰ的ΔH=_____kJ·mol1 。
(2)甲醇燃料电池(Direct Methanol Fuel Cell)属于质子交换膜燃料电池,其工作原理如图所示:
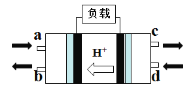
①c处产生的气体是________。
②负极的电极反应式是____________。
(3)下图是甲醇燃料电池工作示意图,其中A,B,D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A,B两极上产生的气体体积相同。
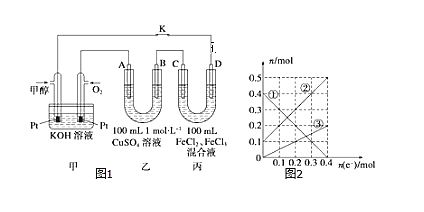
①乙中B极的电极反应式_______。
②乙中A极析出的气体在标况下的体积________。
③丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,则②线表示的是____的变化,反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要____mL 5mol/LNaOH溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等浓度的H2SO4、NaHSO4溶液,分别滴入两份相同的Ba(OH)2溶液中,其电导率与滴入溶液体积变化的曲线如图所示。下列分析正确的是( )
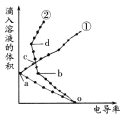
A.b→d反应的离子方程式为:H++OH-=H2O
B.d点溶液中,Na+与SO42-的物质的量之比为1:1
C.c点导电能力相同,所以两溶液中含有相同量的OH-
D.a、b两点Ba2+均沉淀完全,所以对应的溶液均显中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com