
【题目】近来查明二氧化三碳(![]() )是金星大气层的一个组成部分,下列关于
)是金星大气层的一个组成部分,下列关于![]() 说法不正确的是 ( )
说法不正确的是 ( )
A. 结构式可能为:![]() B.
B. ![]() 、CO、
、CO、![]() 都是碳的氧化物
都是碳的氧化物
C. ![]() 不属于酸性氧化物D.
不属于酸性氧化物D. ![]() 、CO都可以燃烧生成
、CO都可以燃烧生成![]()
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中位置,用化学用语回答下列问题:
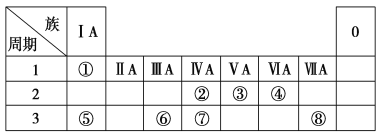
(1)④、⑤、⑥的原子半径由大到小的顺序是________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_____________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种具有漂白性的化合物的电子式:________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2 b.KMnO4 c.Na2SO3 d.Fe2(SO4)3
(5)用电子式表示①与③组成的最简单的化合物的形成过程:_________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是
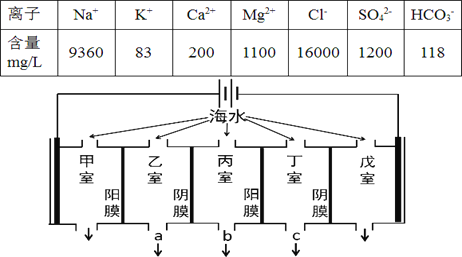
A. 甲室的电极反应式为:2Cl--2e-= Cl2↑
B. 淡化过程中易在戊室形成水垢
C. 乙室和丁室中部分离子的浓度增大,淡水的出口为 b
D. 当戊室收集到22.4L(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇可作为燃料电池的原料。CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,
(1)已知在常温常压下:
①CH3OH(l)+ O2(g)=CO(g) + 2H2O(g); ΔH=﹣355.0 kJ∕mol
②2CO(g)+ O2(g)= 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式:___________________________
(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)=CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是__________
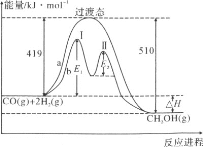
A.上述反应的ΔH=-91kJ·mol-1
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(3)下列是科研小组设计的一个甲醇燃料电池,两边的阴影部分为a,b惰性电极,分别用导线与烧杯的m,n相连接,工作原理示意图如图:
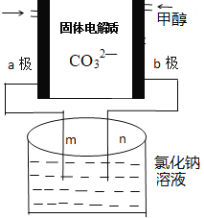
①b极电极反应式为____________。
②在标准状况下,若通入112mL的O2,(假设烧杯中的溶液的体积为200mL,体积不变)最后反应终止时烧杯中溶液的pH为______。
(4)可利用CO2根据电化学原理制备塑料,既减少工业生产对乙烯的依赖,又达到减少CO2排放的目的。以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2进行电解,在阴极可制得低密度聚乙烯![]() (简称LDPE)。
(简称LDPE)。
①电解时,阴极的电极反应式是________。
②工业上生产1.4×102kg的LDPE,理论上需要标准状况下________L的CO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下11.2L,由CO和H2组成的混合气体的质量为7.2g,则混合气体的平均摩尔质量为___;此混合气体完全燃烧,将燃烧产物通过足量过氧化钠后,固体增重___g。
(2)若分别用①KMnO4(还原产物是Mn2+)②MnO2(还原产物是Mn2+)③Ca(ClO)2(还原产物是Cl2)氧化浓盐酸制备氯气,当浓盐酸足量且这三种氧化剂的物质的量相同时,生成氯气的物质的量最少的是___。(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4.6gNa和2.7gAl同时加入到足量的水中充分反应,将反应后的溶液稀释定容为500mL。下列说法不正确的是
A.所得溶液中阳离子和阴离子的物质的量之比为1∶1
B.反应中消耗的水的质量是加入的Al的质量的2倍
C.所得溶液中AlO2-的物质的量浓度为0.2mol/L
D.反应中放出的气体在标准状况下的体积为2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是
A. 用过量石灰乳吸收工业尾气中的SO2: Ca2++2OH-+SO2=CaSO3 ↓+ H2O
B. 用酸性KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4—+6H++5H2O2=2Mn2++5O2 ↑+8H2O
C. 用铜做电极电解NaCl溶液:2C1—+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
D. 将 Fe2O3加入到 HI 溶液中:Fe2O3+ 6H+=2Fe3+ +3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
(1)写出下列物质在水溶液中的电离方程式:
①Ba(OH)2:__________; ②NaHSO4__________
③写出①②水溶液混合后恰好沉淀完全的离子方程式______________
(2)相同物质的量的O2和O3的质量比__________,分子个数比为 __________,所含氧原子的个数比为__________
(3)下列各组物质的分离或提纯,应选用下述方法的哪一种?(填选项字母)
A 分液 B 过滤 C 萃取 D 蒸馏 E 蒸发结晶 F 高温分解
①分离CCl4和H2O__________;
②除去澄清石灰水中悬浮的CaCO3:__________;
③除去CaO固体中少量的CaCO3固体__________;
④从碘水中提取碘__________;
⑤分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物:__________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com