
����Ŀ��ij�غ�ˮ����Ҫ���ӵĺ������±������������������������е���������ԭ����ͼ��ʾ(����Ϊ���Ե缫����Ĥֻ����������ͨ������Ĥֻ����������ͨ��)�������й�˵���������
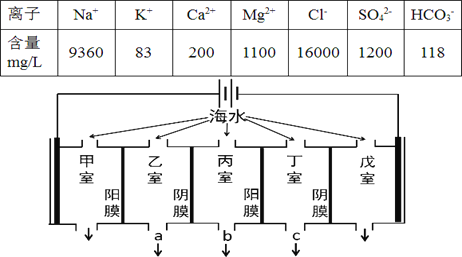
A. ���ҵĵ缫��ӦʽΪ��2Cl-��2e-= Cl2��
B. �������������������γ�ˮ��
C. ���ҺͶ����в������ӵ�Ũ������ˮ�ij���Ϊ b
D. �������ռ���22.4L(��״��)����ʱ��ͨ��������Ĥ�����ӵ����ʵ���һ��Ϊ2mol
���𰸡�D
��������
A. ��ͼ��֪�����ҵ缫���Դ����������Ϊ�����ң�Cl-�ŵ���������OH-�����������ĵ缫��ӦʽΪ��2Cl-��2e-= Cl2������A��ȷ��
B. ��ͼ��֪�����ҵ缫���Դ����������Ϊ�����ң���ʼ���ʱ��������ˮ�õ�����������ͬʱ����OH-�����ɵ�OH-��HCO3-��Ӧ����CO32-��Ca2+ת��ΪCaCO3������OH-��Mg2+����Mg(OH)2��CaCO3��Mg(OH)2��ˮ���ijɷ֣���B��ȷ��
C. ��Ĥֻ����������ͨ������Ĥֻ����������ͨ�������ʱ���������������������������������������Ա�����������Ҫ��ˮ����ˮ�ij���Ϊb��������C��ȷ��
D.����B��ķ����������ռ�������H2���������ռ���22.4L(��״��)����ʱ�����·��ת��2mol���ӣ�ͨ��������Ĥ������Ϊ�����ӣ�����+1�۵����ӣ�����+2�۵����ӣ��������ʵ�������2mol����D������
��ѡD��


 ���������������Բ��������ϵ�д�
���������������Բ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ��һ�������Ե���
A. c(H��)=![]() ����Һ��KwΪ���¶���ˮ�����ӻ�������
����Һ��KwΪ���¶���ˮ�����ӻ�������
B. c(H��)��1.0��10��7mol��L��1����Һ
C. pH��7����Һ
D. �ɵ�����������ʵ���Ũ�ȵ�H2SO4��NaOH��Һ��Ϻ����γɵ���Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�������Ҫ�����������ǣ� ��
A.��ȼ���ȼ�չ���B.�ֻ�﮵�س�����
C.Mg��2HCl=MgCl2��H2��D.H2SO4��2KOH=K2SO4��2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ũ�Ⱦ�Ϊ0.1 mol/L�������ΪV0��HX��HY��Һ���ֱ��ˮϡ�������V��pH��![]() ���仯��ϵ��ͼ��ʾ������������ȷ����
���仯��ϵ��ͼ��ʾ������������ȷ����

A��HX��HY�������ᣬ��HX�����Ա�HY����
B�������£���ˮ�������c(H+)��c��OH -����a<b
C����ͬ�¶��£����볣��K( HX)��a>b
D��![]() =3����ͬʱ��������Һ��������HX ��HY��H2O�Ļӷ�������
=3����ͬʱ��������Һ��������HX ��HY��H2O�Ļӷ�������![]() ��С
��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���к��Ȳⶨʵ���У���50mL0.50mol/L�����50mL0.55mol/LNaOH��Һ����ʵ�飬����˵������ȷ����

A. ����25mL 0.50mol/L�����25mL 0.55 mol/L NaOH��Һ���з�Ӧ��������к�����ֵ��ԭ����ͬ
B. �����ʱ����Ͳ��NaOH��ҺӦ��������С�ձ��У������ò���������
C. װ���еĴ�С�ձ�֮����������ĭ���ϵ������DZ��¸��ȼ���������ʧ
D. ʵ����Ӧ��¼��������Ӧ�����е�����¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��O3Ҳ��һ�ֺܺõ������������и�Ч���ྻ�����㡢���õ��ŵ㡣O3������ˮ����ˮ���ֽ⣬������[O]Ϊ������ԭ�ӣ��к�ǿ��ɱ���������������³�ѹ�·�����Ӧ���£�
��Ӧ����O3![]() O2��[O] ��H��0 ƽ�ⳣ��ΪK1��
O2��[O] ��H��0 ƽ�ⳣ��ΪK1��
��Ӧ���� [O]��O3![]() 2O2 ��H��0 ƽ�ⳣ��ΪK2��
2O2 ��H��0 ƽ�ⳣ��ΪK2��
�ܷ�Ӧ�� 2O3![]() 3O2 ��H��0 ƽ�ⳣ��ΪK��
3O2 ��H��0 ƽ�ⳣ��ΪK��
����������ȷ����( )
A. �����¶ȣ�K��С B. K��K1��K2
C. �ʵ����£����������Ч�� D. ѹǿ����K2��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Ԫ�����ʵĵݱ����������ǣ� ��
A.B��C��Nԭ��������������������
B.Na��Mg��AlԪ�����������������
C.Be��Mg��Ca�ĵ��Ӳ�����������
D.Li��Be��Bԭ�Ӱ뾶��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�鼰�������Ƴ���Ӧ���۵���
ѡ�� | ʵ�� | ���� | ���� |
A | ������KIO3��ʳ���м��������Һ��ϡ���ἰKI | ��Һ����ɫ | �����ԣ�IO3- >I2 |
B | ������Һ����������¼���һ��ʱ����������Ƶ�Cu(OH)2����Һ��ϣ�������� | ��ɫ�������� | ����û��ˮ�� |
C | �����£�����������Ũ�ȵ�NaHCO3��CH3COONa��Һ�зֱ�μ�2�η�̪ | ������Һ����죬NaHCO3��Һ��ɫ���� | �����µ�ˮ��ƽ�ⳣ����Kh(CH3COO-)��Kh(HCO3-) |
D | ����ʱ������֧�Թܸ�ȡ5 mL 0.1 mol/L ����KMnO4��Һ���ֱ����0.1 mol/L��0.2 mol/L H2C2O4��Һ��2 mL | ���Թ���Һ����ɫ���Ҽ�0.2 mol/L H2C2O4��Һ���Թ�����ɫ���� | �����������䣬H2C2O4��Һ��Ũ��Խ��ѧ��Ӧ����Խ�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com