
【题目】下列各组元素性质的递变情况错误的是( )
A.B、C、N原子最外层电子数依次增多
B.Na、Mg、Al元素最高正价依次升高
C.Be、Mg、Ca的电子层数依次增多
D.Li、Be、B原子半径依次增大
科目:高中化学 来源: 题型:
【题目】顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如下转化:

该反应的速率方程可表示为:v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正,逆反应速率常数。回答下列问题:
(1)已知:t1温度下,![]() ,
,![]() ,该温度下反应的平衡常数值K1=_____;该反应的活化能Ea(正)小于Ea(逆),则
,该温度下反应的平衡常数值K1=_____;该反应的活化能Ea(正)小于Ea(逆),则![]() ________0(填“小于”“等于”或“大于”)。
________0(填“小于”“等于”或“大于”)。
(2)t2温度下,图中能表示顺式异构体的质量分数随时间变化的曲线是_______(填曲线编号),平衡常数值K2=_____;温度t2___t1(填“小于”“等于”或“大于”),判断理由是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是
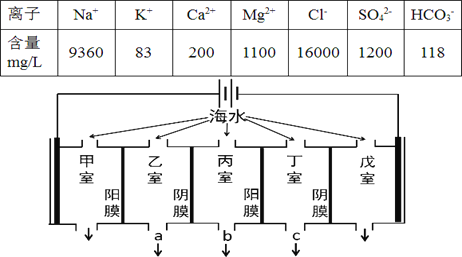
A. 甲室的电极反应式为:2Cl--2e-= Cl2↑
B. 淡化过程中易在戊室形成水垢
C. 乙室和丁室中部分离子的浓度增大,淡水的出口为 b
D. 当戊室收集到22.4L(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如下图所示,下列说法错误的是

A. 反应总过程ΔH<0
B. Fe+使反应的活化能减小
C. FeO+也是该反应的催化剂
D. Fe++N2O![]() FeO++N2、FeO++CO
FeO++N2、FeO++CO![]() Fe++CO2两步反应均为放热反应
Fe++CO2两步反应均为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A. c1∶c2=3∶1 B. 平衡时,Y和Z的生成速率之比为2∶3
C. X、Y的转化率不相等 D. c1的取值范围为0<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NCl3既可用于漂白,又可用于柠檬等水果的熏蒸处理。已知:NCl3熔点为-40℃,沸点为70℃, 95℃以上易爆炸,有刺激性气味,在热水中易水解。实验室可用Cl2和NH4Cl溶液反应制取NCl3。某小组利用如图所示的装置制备NCl3,并探究NCl3的漂白性。

回答下列问题:
(1)仪器M中盛放的试剂为_________。
(2)各装置接口连接的顺序为__________(用小写字母表示)。
(3)当装置B的蒸馏烧瓶中出现较多油状液体后,关闭b处的活塞,应控制水浴加热的温度为_______,装置C的作用为_________。
(4)当装置D的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50~60℃的热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,则试纸先变蓝后褪色。结合化学方程式解释该现象:___________________。
(5)在pH=4时电解NH4Cl溶液也可以制得NCl3,然后利用空气流将产物带出电解槽。电解池中产生NCl3的电极为_______(填“阴极”或“阳极”),该电极的电极反应式为________。
(6)NCl3可与NaClO2溶液反应制取ClO2气体,同时产生一种无污染的气体,该反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石油化工的一种产品A(乙烯)为主要原料合成一种具有果香味的物质E的生产流程如下:
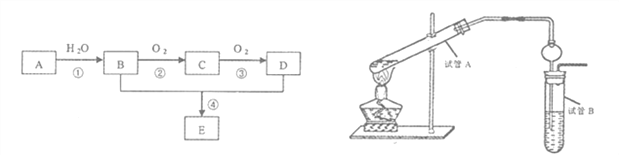
(1)写出步骤①的化学方程式_______________反应类型__________;
步骤②的化学方程式______________反应类型__________;
(2)某同学欲用上图装置制备物质E,回答以下问题:
①试管A发生反应的化学方程式_______________________;
②试管B中的试剂是______________________;分离出乙酸乙酯的实验操作是______________(填操作名称),用到的主要玻璃仪器为____________________;
③插入右边试管的导管接有一个球状物,其作用为_______________________。
(3)为了制备重要的有机原料——氯乙烷(CH3—CH2Cl),下面是两位同学设计的方案。
甲同学:选乙烷和适量氯气在光照条件下制备,原理是:
CH3—CH3+Cl2 ![]() CH3—CH2Cl+HCl
CH3—CH2Cl+HCl
乙同学:选乙烯和适量氯化氢在一定条件下制备,原理是:
CH2=CH2+HCl→CH3—CH2Cl
你认为上述两位同学的方案中,合理的是____,简述你的理由:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组参观制碱厂后,绘制了该厂生产纯碱的工艺流程图如图。据图判断下列说法错误的是( )

A. 流程图Ⅰ是依次向粗盐水中加入Ca(OH)2和Na2CO3,二者加入的顺序可以颠倒
B. 流程Ⅰ后过滤得到的沉淀成分有Mg(OH)2和CaCO3
C. 通入NH3的主要作用是形成碱性溶液,有利于CO2的吸收
D. 碳酸氢钠首先从溶液中结晶析出的原因其溶解度较小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某城市主要空气污染物为PM2.5、SO2、NOx。科学实验小组为检测空气样本成分,用蒸馏水处理制成待测液,设计实验及所得实验现象如下:
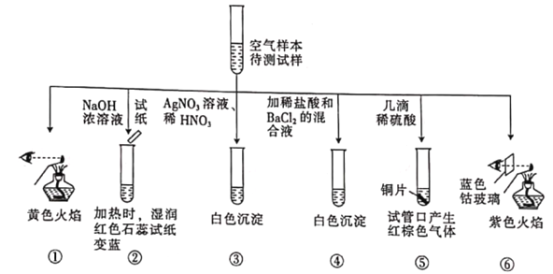
下列判断不正确的是
A. 上述实验中可用Ba(NO3)2代替BaCl2,以证明待测试样中含SO42-
B. 由实验②⑤可知待测试样中含有NH4+和NO3-
C. 焰色反应表明待测试样中含Na元素和K元素
D. 该城市的污染来源主要是燃煤和机动车尾气排放
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com