
【题目】下列溶液,一定呈中性的是
A. c(H+)=![]() 的溶液(Kw为该温度下水的离子积常数)
的溶液(Kw为该温度下水的离子积常数)
B. c(H+)=1.0×10-7mol·L-1的溶液
C. pH=7的溶液
D. 由等体积、等物质的量浓度的H2SO4跟NaOH溶液混合后所形成的溶液
【答案】A
【解析】
溶液的酸碱性是根据溶液中H+浓度与OH-浓度的相对大小判断,不能直接根据溶液的pH进行判断,
当c(H+)>c(OH-),溶液就呈酸性;
当c(H+)=c(OH-),溶液就呈中性;
当溶液中c(H+)<c(OH-),溶液就呈碱性;
A、KW=c(H+)c(OH-),c(H+)=![]() ,即c(H+)=c(OH-),故溶液显中性,故A正确,
,即c(H+)=c(OH-),故溶液显中性,故A正确,
B、c(H+)=10-7mol·L-1的溶液,溶液的pH=7,pH=7的溶液不一定呈中性,如100℃时,水的离子积常数是10-12,当pH=6时溶液呈中性,当pH=7时溶液呈碱性,故B错误;
C、pH=7的溶液不一定呈中性,如100℃时,水的离子积常数是10-12,当pH=6时溶液呈中性,当pH=7时溶液呈碱性,故C错误;
D、由等体积、等物质的量浓度的硫酸与NaOH溶液混合后,充分反应后,硫酸过量,溶液呈酸性,故D错误;
故选A。


科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z和M在周期表中的位置如图所示,Y原子序数是X的2倍。下列说法不正确的是
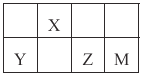
A. Z、M、X的简单离子半径依次减小
B. Y和M可形成离子化合物YM4
C. X的简单气态氢化物的稳定性强于Y的
D. M的最高价氧化物对应水化物的酸性比Z的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如下转化:

该反应的速率方程可表示为:v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正,逆反应速率常数。回答下列问题:
(1)已知:t1温度下,![]() ,
,![]() ,该温度下反应的平衡常数值K1=_____;该反应的活化能Ea(正)小于Ea(逆),则
,该温度下反应的平衡常数值K1=_____;该反应的活化能Ea(正)小于Ea(逆),则![]() ________0(填“小于”“等于”或“大于”)。
________0(填“小于”“等于”或“大于”)。
(2)t2温度下,图中能表示顺式异构体的质量分数随时间变化的曲线是_______(填曲线编号),平衡常数值K2=_____;温度t2___t1(填“小于”“等于”或“大于”),判断理由是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离可达到平衡:H2O![]() H++OH- ΔH>0。下列叙述正确的是
H++OH- ΔH>0。下列叙述正确的是
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 将水加热,Kw增大,pH不变
C. 向水中加入少量CH3COONa固体,平衡逆向移动,c (H+)降低
D. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2SO3溶液中混有 NaHSO3,要提纯Na2SO3溶液,可用三室法电解实现,如图所示。下列说法不正确的是
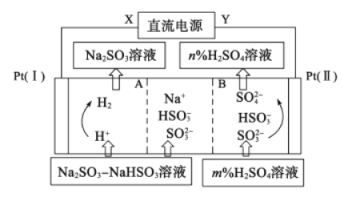
A. A为阳离子交换膜,B为阴离子交换膜
B. X为直流电源的负极,阳极区pH减小
C. 图中的n<m
D. 阴极的电极反应式为2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某氟化稀土样品中氟元素的质量分数,某化学兴趣小组进行了如下实验,利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(低沸点酸)并蒸出,再通过滴定测量。实验装置如图所示。
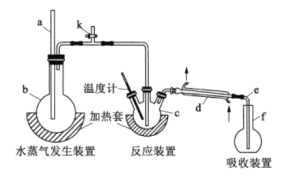
(1)a的作用是__________,仪器d的名称是__________。
(2)检查装置气密性:在b和f中加水,使水浸没导管a和e末端,__________,停止加热,导管e内有一段稳定的水柱,说明装置气密性良好。(补全以上操作过程中的空缺内容)
(3)c中加入一定体积高氯酸溶液和0.100g氟化稀土样品,f中盛有滴加酚酞的 NaOH溶液。加热b、c,使b中产生的水蒸气进入c。
①下列物质中可代替高氯酸的是________(填序号)。
a.硝酸 b.盐酸 c.硫酸 d.磷酸
②若观察到f中溶液红色褪去,需要向f中及时补加NaOH溶液,否则会使实验结果偏低,原因是___________________;实验中除有HF气体外,可能还有少量SiF4(易水解)气体生成,但实验结果不受影响,原因是__________(用化学方程式表示)。
(4)向馏出液中加入25.00mL0.100mol/LLa(NO3)3溶液,得到LaF3沉淀,再用0.100mol/LEDTA标准溶液滴定剩余La3+( La3+与EDTA按1:1结合),消耗EDTA标准溶液22.00mL,则氟化稀土样品中氟元素的质量分数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是
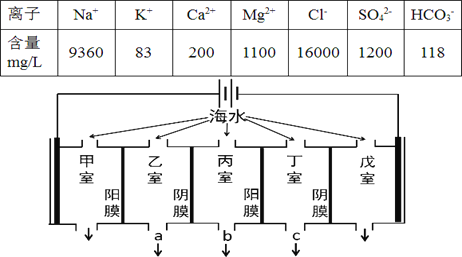
A. 甲室的电极反应式为:2Cl--2e-= Cl2↑
B. 淡化过程中易在戊室形成水垢
C. 乙室和丁室中部分离子的浓度增大,淡水的出口为 b
D. 当戊室收集到22.4L(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石油化工的一种产品A(乙烯)为主要原料合成一种具有果香味的物质E的生产流程如下:
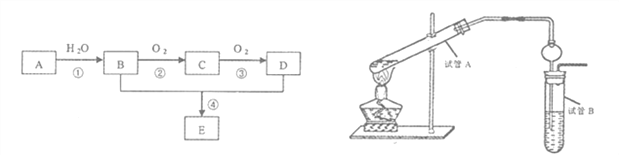
(1)写出步骤①的化学方程式_______________反应类型__________;
步骤②的化学方程式______________反应类型__________;
(2)某同学欲用上图装置制备物质E,回答以下问题:
①试管A发生反应的化学方程式_______________________;
②试管B中的试剂是______________________;分离出乙酸乙酯的实验操作是______________(填操作名称),用到的主要玻璃仪器为____________________;
③插入右边试管的导管接有一个球状物,其作用为_______________________。
(3)为了制备重要的有机原料——氯乙烷(CH3—CH2Cl),下面是两位同学设计的方案。
甲同学:选乙烷和适量氯气在光照条件下制备,原理是:
CH3—CH3+Cl2 ![]() CH3—CH2Cl+HCl
CH3—CH2Cl+HCl
乙同学:选乙烯和适量氯化氢在一定条件下制备,原理是:
CH2=CH2+HCl→CH3—CH2Cl
你认为上述两位同学的方案中,合理的是____,简述你的理由:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com