
【题目】Na2SO3溶液中混有 NaHSO3,要提纯Na2SO3溶液,可用三室法电解实现,如图所示。下列说法不正确的是
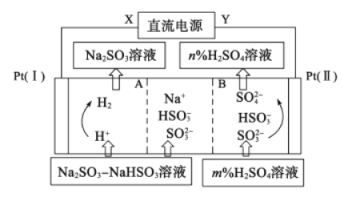
A. A为阳离子交换膜,B为阴离子交换膜
B. X为直流电源的负极,阳极区pH减小
C. 图中的n<m
D. 阴极的电极反应式为2H++2e-=H2↑
【答案】C
【解析】
A.根据阴阳离子移动方向可知A为阳离子交换膜,B为阴离子交换膜,A正确;
B.Pt(I)电极为阴极,Pt(II)电极为阳极,所以X电极为直流电源负极,Y电极为直流电源正极,在阳极上,溶液中的SO32-、HSO3-被氧化变为SO42-,SO32--2e-+H2O=SO42-+2H+;HSO3--2e-+H2O=SO42-+3H+,c(H+)增大,溶液的酸性增强,所以pH减小,B正确;
C.阳极室出来的硫酸溶液中不仅有加入的硫酸,还有SO32-、HSO3-被氧化产生的硫酸,所以硫酸溶液的浓度n>m,C错误;
D.离子放电顺序:H+>Na+,所以在该电池中阴极上溶液中H+放电,产生氢气,电极反应式为2H++2e-=H2↑,D正确;
故合理选项是C。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,无水LiCl-KCl混合物受热熔融后,电池即可瞬间输岀电能。该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法不正确的是
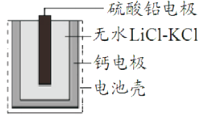
A. 放电时,电子由Ca电极流出
B. 放电时,Li+向PbSO4电极移动
C. 负极反应式:PbSO4+2e-+Li+=Li2SO4+Pb
D. 每转移0.2mol电子,理论上生成还原产物Pb的质量为20.7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料,常温下可与烧碱溶液发生反应:AlN+NaOH+3H2O=NaAl(OH)4+NH3↑。某课题小组利用甲图所示装置测定样品中AlN的含量(杂质不反应,量气管为碱式滴定管改造)。下列说法正确的是

A. 量气管中的液体应为水
B. 用长颈漏斗代替分液漏斗,有利于控制反应速率
C. 反应结束时,a、b两管液面的差值即为产生气体的体积
D. 若其它操作均正确,实验结束时按乙图读数,测得AlN含量偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液,一定呈中性的是
A. c(H+)=![]() 的溶液(Kw为该温度下水的离子积常数)
的溶液(Kw为该温度下水的离子积常数)
B. c(H+)=1.0×10-7mol·L-1的溶液
C. pH=7的溶液
D. 由等体积、等物质的量浓度的H2SO4跟NaOH溶液混合后所形成的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应或过程需要吸收能量的是( )
A.可燃物的燃烧过程B.手机锂电池充电过程
C.Mg+2HCl=MgCl2+H2↑D.H2SO4+2KOH=K2SO4+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行实验,下列说法不正确的是

A. 改用25mL 0.50mol/L盐酸跟25mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同
B. 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌
C. 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热减少热量损失
D. 实验中应记录测量出反应过程中的最高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象能正确反映对应的变化关系的是( )
A. 向一定量的稀硫酸中滴加氢氧化钠

B. 向一定量的H2SO4和MgSO4混合溶液中滴加氢氧化钡溶液

C. 将足量块状MgCO3和MgO粉末分别加入相同质量、相同质量分数的稀盐酸中
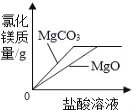
D. 在一定温度下,向不饱和的硝酸钠溶液中不断加入硝酸钠固体,充分搅拌

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com