
【题目】为测定某氟化稀土样品中氟元素的质量分数,某化学兴趣小组进行了如下实验,利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(低沸点酸)并蒸出,再通过滴定测量。实验装置如图所示。
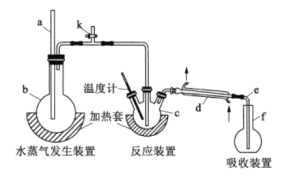
(1)a的作用是__________,仪器d的名称是__________。
(2)检查装置气密性:在b和f中加水,使水浸没导管a和e末端,__________,停止加热,导管e内有一段稳定的水柱,说明装置气密性良好。(补全以上操作过程中的空缺内容)
(3)c中加入一定体积高氯酸溶液和0.100g氟化稀土样品,f中盛有滴加酚酞的 NaOH溶液。加热b、c,使b中产生的水蒸气进入c。
①下列物质中可代替高氯酸的是________(填序号)。
a.硝酸 b.盐酸 c.硫酸 d.磷酸
②若观察到f中溶液红色褪去,需要向f中及时补加NaOH溶液,否则会使实验结果偏低,原因是___________________;实验中除有HF气体外,可能还有少量SiF4(易水解)气体生成,但实验结果不受影响,原因是__________(用化学方程式表示)。
(4)向馏出液中加入25.00mL0.100mol/LLa(NO3)3溶液,得到LaF3沉淀,再用0.100mol/LEDTA标准溶液滴定剩余La3+( La3+与EDTA按1:1结合),消耗EDTA标准溶液22.00mL,则氟化稀土样品中氟元素的质量分数为________________。
【答案】平衡压强 直形冷凝管 关闭k,微热c,导管e末端有气泡冒出 cd 充分吸收HF气体,防止其挥发损失 SiF4+3H2O=H2SiO3↓+4HF(或SiF4+4H2O=H4SiO4↓+4HF) 17.1%
【解析】
(1)a为长玻璃管,主要是平衡压强,防止烧瓶中压强过大引起爆炸,d仪器为直形冷凝管;
(2)检查装置气密性:在b和f中加水,使水浸没导管a和e末端,关闭k,微热c,导管e末端有气泡冒出,证明气密性良好,停止加热;
(3)①利用高氯酸为高沸点酸将样品中的氟元素转化为氟化氢低沸点酸蒸出。
a.硝酸为易挥发性酸,不符合要求,A错误;
b.盐酸是易挥发性酸,不符合要求,B错误;
c.硫酸是难挥发性酸沸点高,可代替高氯酸,C正确;
d.磷酸为高沸点酸,难挥发,可代替高氯酸的,D正确;
故合理选项是cd;
②若观察到f中溶液红色褪去,需要向f中及时补加氢氧化钠溶液,否则会使实验结果偏低,原因是充分吸收HF气体防止其挥发损失;实验中除有HF气体外,可能含有少量SiF4气体,四氟化氢易水解生成HF,若有SiF4生成,反应方程式为SiF4+3H2O=H2SiO3↓+4HF,或写为SiF4+4H2O=H4SiO4↓+4HF,所以对实验结果不受影响;
(4)向馏出液中加入25.00mL0.100mol/LLa(NO3)3溶液,得到LaF3沉淀,再用0.100mol/LEDTA标准溶液滴定剩余La3+( La3+与EDTA按1:1结合),消耗EDTA标准溶液22.00mL,则氟化稀土样品中氟的质量分数=![]() =17.1%。
=17.1%。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯实验装置和步骤如下:
(实验步骤)
取100 mL烧杯,用20 mL浓硫酸与18 mL浓硝酸配制混合液,将混合酸小心加入B中,把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀,在50~60℃下发生反应,直至反应结束。

将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5% NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210 ℃馏分,得到纯硝酸基苯18.00 g。请回答:
(1)装置B的名称是________,装置C的作用是________________。
(2)实验室制备硝基苯的化学方程式是____________________________。
(3)配制混合液时,_____(填“能”或“不能”)将浓硝酸加入到浓硫酸中,说明理由_________。
(4)为了使反应在50~60 ℃下进行,常用的方法是__________。
(5)在洗涤操作中,第二次水洗的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置如下图所示。下列说法正确的是( )

A. 燃料电池工作时,正极反应为:O2+ 2H2O + 4e-= 4OH-
B. 若a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C. 若a、b极都是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等
D. 若a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液,一定呈中性的是
A. c(H+)=![]() 的溶液(Kw为该温度下水的离子积常数)
的溶液(Kw为该温度下水的离子积常数)
B. c(H+)=1.0×10-7mol·L-1的溶液
C. pH=7的溶液
D. 由等体积、等物质的量浓度的H2SO4跟NaOH溶液混合后所形成的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当前能源危机是一个全球性问题,开源节流是应对能源危机的重要举措。
(1)下列做法有利于能源“开源节流”的是________(填字母)。
A.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
B.大力开采煤、石油和天然气以满足人们日益增长的能源需求
C.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
D.减少资源消耗,加大资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。

则在通常状况下,金刚石和石墨相比较,________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热ΔH=________。
(3)已知:N2、O2分子中化学键的键能分别是946kJ/mol、497kJ/mol。N2(g)+O2(g)=2NO(g) ΔH= +180.0kJ/mol。NO分子中化学键的键能为__________________kJ/mol。
(4)综合上述有关信息,请写出用CO除去NO生成无污染气体的热化学方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应或过程需要吸收能量的是( )
A.可燃物的燃烧过程B.手机锂电池充电过程
C.Mg+2HCl=MgCl2+H2↑D.H2SO4+2KOH=K2SO4+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.1 mol/L、体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随![]() 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是

A.HX、HY都是弱酸,且HX的酸性比HY的弱
B.常温下,由水电离出的c(H+)·c(OH -):a<b
C.相同温度下,电离常数K( HX):a>b
D.![]() =3,若同时微热两种溶液(不考虑HX 、HY和H2O的挥发),则
=3,若同时微热两种溶液(不考虑HX 、HY和H2O的挥发),则![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:
反应①:O3![]() O2+[O] ΔH>0 平衡常数为K1;
O2+[O] ΔH>0 平衡常数为K1;
反应②: [O]+O3![]() 2O2 ΔH<0 平衡常数为K2;
2O2 ΔH<0 平衡常数为K2;
总反应: 2O3![]() 3O2 ΔH<0 平衡常数为K。
3O2 ΔH<0 平衡常数为K。
下列叙述正确的是( )
A. 降低温度,K减小 B. K=K1+K2
C. 适当升温,可提高消毒效率 D. 压强增大,K2减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得诺贝尔化学奖。轮烷是一种分子机器的“轮子”,芳香化合物a、b、c是合成轮烷的三种原料,其结构如下图所示。下列说法不正确的是

A. b、c互为同分异构体
B. a、c分子中所有碳原子均有可能处于同一平面上
C. a、b、c均能发生氧化反应、加成反应、加聚反应和酯化反应
D. a、b、c均能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com