
【题目】为了探究硫酸亚铁的分解产物,进行了如下图装置所示的实验,打开K1和K2,缓缓通入N2,一段时间后加热,实验后反应管中残留固体为红色粉末,BaCl2溶液中有白色沉淀产生,品红溶液中红色褪去,检查氢氧化钠溶液出口处无氧气产生。下列说法错误的是

A. 氢氧化钠溶液的作用是吸收多余的SO2气体
B. 反应管内产生的红色粉末可能是Fe2O3
C. BaCl2溶液的目的是检验SO3的存在,此处用Ba(NO3)2溶液也可以检验SO3
D. 反应管内得到的氧化产物和还原产物物质的量之比为1:1
【答案】C
【解析】氢氧化钠溶液的作用是吸收多余的酸性气体,避免污染空气,选项A正确。硫酸亚铁受热分解,产生的红色固体一定含有Fe元素,所以可能是Fe2O3,选项B正确。如果二氧化硫气体,通入硝酸钡溶液中,因为二氧化硫溶于水溶液显酸性,酸性条件下,硝酸根离子将二氧化硫氧化为硫酸,再与钡离子生成硫酸钡沉淀。所以用硝酸钡溶液的问题是:无法判断使硝酸钡溶液出现白色沉淀的是二氧化硫还是三氧化硫,选项C错误。实验后反应管中残留固体为红色粉末(Fe2O3),BaCl2溶液中有白色沉淀产生(说明有SO3),品红溶液中红色褪去(说明有SO2),检查氢氧化钠溶液出口处无氧气产生,所以分解的方程式为:2FeSO4 ![]() Fe2O3 + SO3↑+ SO2↑,所以氧化产物(Fe2O3)和还原产物(SO2)物质的量之比为1:1,选项D正确。
Fe2O3 + SO3↑+ SO2↑,所以氧化产物(Fe2O3)和还原产物(SO2)物质的量之比为1:1,选项D正确。


科目:高中化学 来源: 题型:
【题目】某地海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是
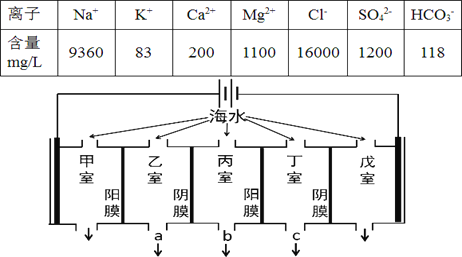
A. 甲室的电极反应式为:2Cl--2e-= Cl2↑
B. 淡化过程中易在戊室形成水垢
C. 乙室和丁室中部分离子的浓度增大,淡水的出口为 b
D. 当戊室收集到22.4L(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是
A. 用过量石灰乳吸收工业尾气中的SO2: Ca2++2OH-+SO2=CaSO3 ↓+ H2O
B. 用酸性KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4—+6H++5H2O2=2Mn2++5O2 ↑+8H2O
C. 用铜做电极电解NaCl溶液:2C1—+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
D. 将 Fe2O3加入到 HI 溶液中:Fe2O3+ 6H+=2Fe3+ +3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素,A元素的一种核素无中子,F元素的最外层电子数是次外层电子数的0.75倍,B元素的的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:
(1)A、D、F形成化合物的电子式_____________。
(2)工业上在高温的条件下,可以用A2C和BC反应制取单质A2。在2L密闭容器中分别充入1 mol A2C和1 mol BC, —定条件下,2 min达平衡时生成0.4mol A2,则用BC表示的反应速率为________。下列关于该反应的说法中正确的是__________________。
A.增加BC2的浓度始终不能提高正反应速率
B.若混合气体的密度不再发生变化,则反应达到最大限度
C.A2是一种高效优质新能源
D.若生成1 molA2,转移2mol电子
(3)用A元素的单质与C元素的单质及由A、C、D三种元素组成的化合物的溶液构成燃料电池,写出该电池的电极反应式:负极____________,正极_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
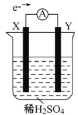
【题目】如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是
 .
.
A. 外电路的电流方向为:X→导线→Y
B. 若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C. X极上发生的是还原反应,Y极上发生的是氧化反应
D. 若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图,下列有关该电池的说法正确的是( )
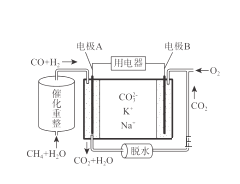
A. 反应CH4+3H2O 3H2+CO消耗1mol CH4转移4mol电子
3H2+CO消耗1mol CH4转移4mol电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
(1)写出下列物质在水溶液中的电离方程式:
①Ba(OH)2:__________; ②NaHSO4__________
③写出①②水溶液混合后恰好沉淀完全的离子方程式______________
(2)相同物质的量的O2和O3的质量比__________,分子个数比为 __________,所含氧原子的个数比为__________
(3)下列各组物质的分离或提纯,应选用下述方法的哪一种?(填选项字母)
A 分液 B 过滤 C 萃取 D 蒸馏 E 蒸发结晶 F 高温分解
①分离CCl4和H2O__________;
②除去澄清石灰水中悬浮的CaCO3:__________;
③除去CaO固体中少量的CaCO3固体__________;
④从碘水中提取碘__________;
⑤分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物:__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习小组在实验室中对铁盐与亚铁盐的相互转化进行如下探究。
已知:SCN-具有强还原性,易被氧化为(SCN)2。
实验Ⅰ:Fe3+转化为Fe2+
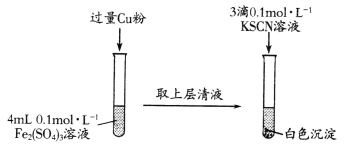
(1)Fe2(SO4)3溶液与Cu粉发生反应的离子方程式为________________________。
(2)探究白色沉淀产生的原因:
①提出假设:
假设1:白色沉淀是Fe2+与SCN-直接结合所得;
假设2:白色沉淀是Cu2+与SCN-直接结合所得;
假设3:_____________________________________________。
②实验验证:
向CuSO4溶液中通人过量SO2,将Cu2+还原,再加入KSCN溶液,观察到有白色沉淀生成,证明假设三成立。写出CuSO4溶液与KSCN溶液反应的离子方程式:________。
实验Ⅱ:Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL 0.1mol·L-1 FeSO4溶液中加入3mL 4mol·L-1稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
(3)实验Ⅱ中,Fe2+转化为Fe3+的离子方程式是_____________________________。
(4)设计如下实验,探究溶液变为棕色的原因:
①向Fe2(SO4)3溶液中通入NO,溶液颜色无变化
②向FeSO4溶液中通入NO,溶液颜色变为棕色
③向Fe(NO3)3溶液中通入NO,溶液颜色无变化
由上述实验分析溶液变为棕色的原因是_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com