
【题目】“共生系统”能很大程度上提高经济效益。研究硫酸工业尾气的“共生系统”具有重要意义。回答下列问题:
(1)工业上,将Na2CO3和Na2S以合适的物质的量比配成溶液,吸收富集的SO2,可制取重要的化工原料Na2S2O3,同时放出CO2。该反应的化学方程式为___________________。
(2)工业上,将富含SO2的工业尾气降温液化,收集液态SO2。用液态SO2、硫磺(用S表示)、液氯为原料,在200℃~250℃活性炭催化条件下合成氯化剂SOCl2。该反应中氧化剂与还原剂的物质的量之比为________________。
(3)SOCl2分子的空间构型为______________。下列关于O、S、Se三种同主族元素的叙述正确的是____________(填序号)。
a.沸点:H2O>H2S>H2Se
b.H2O分子中H—O—H键的键角小于H2S分子中H—S—H键的键角
c.热稳定性H2O>H2S>H2Se
d.CS2是一种直线型分子,分子中C、S原子都满足8电子稳定结构
(4)氯化亚砜(SOCl2,易挥发液体,易水解)常用作脱水剂。ZnCl2·xH2O制取无水ZnCl2流程如图所示:
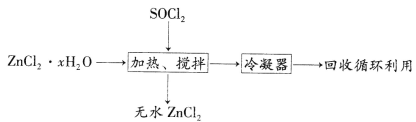
①利用SOCl2和ZnCl2·xH2O混合加热可制得无水ZnCl2的原因是_________________________________(用化学方程式和必要的文字解释)。
②甲同学认为SOCl2也可用于FeCl3·6H2O制取无水FeCl3,但乙同学认为该过程会发生氧化还原反应。要验证乙同学观点是否正确,可选择下列试剂中的___________(填序号)。
a.K3[Fe(CN)6]溶液 b.BaCl2溶液和稀盐酸
c.AgNO3溶液和稀硝酸 d.酸性KMnO4溶液
【答案】Na2CO3+2Na2S+4SO2= 3Na2S2O3+CO2 2:1 三角锥形 cd SOCl2易水解,发生反应SOCl2+H2O= SO2↑+2HCl↑或xSOCl2+ZnCl2·xH2O+H2O= ZnCl2 +xSO2↑+2xHCl↑,生成的HCl抑制Zn2+水解,故可制得无水ZnCl2 ad
【解析】
(1) 根据题意可知,SO2和Na2S发生氧化还原反应,生成Na2S2O3;
(2) Cl2为氧化剂,S为还原剂根据化合价升降法确定系数;
(3) SOCl2分子中S为中心原子,为sp3杂化;根据同族元素原子的结构及其性质的递变性进行分析。
(4) ①已知SOCl2易水解,可与ZnCl2·xH2O提供的水反应发生SOCl2+H2O= SO2+2HCl,且生成的HCl能够抑制锌离子的水解,导致ZnCl2·xH2O失去水,从而得到无水ZnCl2;
②若乙同学观点正确,则生成的氯化铁固体中含有氯化亚铁杂质,可将少量固体溶于稀盐酸中,加入K3[Fe(CN)6]溶液显蓝色或滴加酸性KMnO4溶液,紫色褪去即可。
(1) 根据题意可知,SO2和Na2S发生氧化还原反应,生成Na2S2O3,反应的化学方程式为Na2CO3+2Na2S+4SO2= 3Na2S2O3+CO2;
(2) 以SO2、S、Cl2为原料制取SOCl2中,Cl2为氧化剂,化合价由0价变为-1,S为还原剂,化合价由0价变为+4,而SO2的化合价未变,则化合价改变值的最小公倍数为4,则的系数为2,S的系数为1,氧化剂与还原剂的物质的量之比为2:1;
(3) SOCl2分子中S为中心原子,共3条键,有1对孤电子对,为sp3杂化,则为三角锥形;
a.H2O间存在氢键,分子间的作用力增大,沸点较高,而H2S、H2Se分子间无氢键,沸点与分子量有关,分子量越大,分子间的作用力越强,沸点越高,则沸点:H2O>H2Se >H2S,a错误;
b.O原子半径小于S,导致电子对与原子核距离变小,则H2O分子中H、O间的成键电子对间的斥力变大,H—O—H键的键角大于H2S分子中H—S—H键的键角,b错误;
c.O、S、Se三种同主族元素,非金属性越强,则热稳定性越高,则热稳定性H2O>H2S>H2Se,c正确;
d.CS2是一种直线型分子,中心原子为sp杂化,分子中C、S原子间形成C=S键,则都满足8电子稳定结构,d正确;
答案为cd;
(4) ①已知SOCl2易水解,可与ZnCl2·xH2O提供的水反应发生SOCl2+H2O= SO2+2HCl,且生成的HCl能够抑制锌离子的水解,导致ZnCl2·xH2O失去水,从而得到无水ZnCl2;
②若乙同学观点正确,则生成的氯化铁固体中含有氯化亚铁杂质,可将少量固体溶于稀盐酸中,加入K3[Fe(CN)6]溶液显蓝色或滴加酸性KMnO4溶液,紫色褪去即可,综上所述,答案为ad。


科目:高中化学 来源: 题型:
【题目】化学实验是化学学习的重要内容。根据你掌握的知识,完成下面内容。
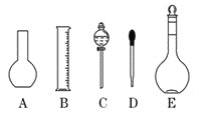
(1)实验室需要0.1 mol/L NaOH溶液480 mL, 根据溶液的配制情况回答下列问题:
①如图所示的仪器中配制溶液肯定不需要的是________(填序号);
②由计算得知,应选择________mL的容量瓶,用托盘天平称取________g NaOH。
③在配制NaOH溶液实验中,其他操作均正确。若定容时仰视刻度线, 则所配制溶液浓度________0.1 mol/L (填“大于”“等于”或“小于”,下同);溶解NaOH后的溶液需冷却到室温后方能转移入容量瓶中。若趁热转移会使所配制溶液浓度________0.1 mol/L。
(2)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.萃取分液 B.升华 C.蒸发结晶 D.过滤 E.蒸馏 F.分液
①除去洗菜水里的菜叶子和泥土________;
②从食盐水里获得食盐固体________;
③从碘和沙子混合物中获得碘________;
④从溴水中获得溴________;
⑤分离CCl4 沸点为76.75℃和甲苯沸点为110.6℃的混合物________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图:A处通入氯气,关闭B时,C中红色布条颜色无变化;当打开B时,C处红色布条颜色褪去。则相关判断正确的是
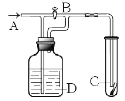
A.通入的Cl2含有水蒸气B.D中不可能是浓H2SO4
C.D中可能是水D.D中可能是饱和食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年。已知X、Y、Z、W、M均为短周期元素。25℃时,其最高价氧化物对应的水化物(浓度均为0.01mol·L-1)溶液的pH和原子半径的关系如图所示。下列说法不正确的是( )
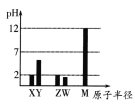
A.Y的最高价氧化物的化学式可能为YO2
B.五种元素中只有一种是金属元素
C.W、M简单离子半径大小顺序:W<M
D.X的最简单气态氢化物和Z的气态氢化物反应产物中含有离子键和共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)如表是A、B两种有机物的有关信息:
A | B |
①分子模型为: ②能使溴的四氯化碳溶液褪色; ③其产量是衡量石油化工水平的标志。 | ①由C、H、O三种元素组成,是厨房中的常见调味剂; ②水溶液能使紫色石蕊试液变红。 |
根据表中信息回答下列问题:
(1)关于A的下列说法中,不正确的是_____(填标号)。
a.分子里含有碳碳双键 b.分子里所有的原子共平面 c.结构简式为CH2-CH2
(2)A与H2发生加成反应后生成X,与X在分子组成和结构上相似的有机物有一大类,它们的通式为CnH2n+2。当n=___时,这类机物开始出现同分异构休。
(Ⅱ)已知有机物A~F有如图转化关系:
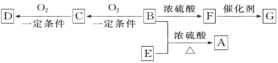
已知:①2CH3CHO+O2![]() 2CH3COOH+2H2O;
2CH3COOH+2H2O;
②CH3CH2OH![]() CH2=CH2↑+H2O(该反应属于消去反应)。
CH2=CH2↑+H2O(该反应属于消去反应)。
③A的分子式为C10H20O2; ④B分子中含2个甲基;⑤D、E互为具有相同官能团的同分异构体,D能与碳酸氢钠反应放出CO2,E分子烃基上的氢原子若被Cl取代,其一氯代物有3种;⑥F可以使溴的四氯化碳溶液褪色,G为高分子化合物。请填写以下空白:
(1)B可以发生的反应有_____(填序号)。
①取代反应 ②消去反应 ③加聚反应 ④氧化反应
(2)D分子所含有的官能团的名称是________。
(3)写出与D、E具有相同官能团的同分异构体(D、E除外)可能的结构简式______。
(4)写出下列转化的化学方程式:
B+E→A:_______;
B→C:___________;
F→G:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入 1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
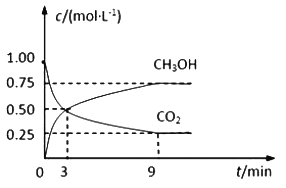
(1)从3 min到9 min,υ(H2)=________mol·L-1·min-1。
(2)能说明上述反应达到平衡状态的是____________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)平衡时CO2的转化率为______________。
(4)平衡时混合气体中CH3OH(g)的体积分数是__________________。
(5)一定温度下,第9分钟时υ逆(CH3OH) _______(填“大于”、“小于”或“等于”)第3分钟时υ正(CH3OH)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在NH3和NH4Cl存在条件下,以活性炭为催化剂,用H2O2氧化CoCl2溶液来制备化工产品[Co(NH3)6]Cl3,下列表述正确的是
A. [Co(NH3)6]Cl3中Co的化合价是+3B. H2O2 的电子式:![]()
C. NH3和NH4Cl化学键类型相同D. 中子数为32,质子数为27的钴原子:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟道气的主要成分为粉尘、空气、H2O、NOx,其中NOx是主要的大气污染物之一,为了监测某工厂烟道气中NOx含量,采集标准状况下50.00 L烟道气样经除尘、干燥后缓慢通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO3,除去多余的H2O2并加水稀释至100.00 mL。量取20.00 mL该溶液,加入30.00 mL 0.01000 mol·L1FeSO4标准溶液(过量),充分反应后,用0.001000 mol·L1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液10.00 mL。滴定过程中发生如下反应:
Fe2+ + NO3 + H+ — NO↑ + Fe3+ + H2O (未配平)
![]() + Fe2+ + H+ — Cr3+ + Fe3++ H2O (未配平)
+ Fe2+ + H+ — Cr3+ + Fe3++ H2O (未配平)
(1)NO被H2O2氧化为NO3的离子方程式是_________。
(2)配制100mL 0.001000 mol·L1 K2Cr2O7标准溶液时,除需用到烧杯、量筒、玻璃棒外,还需用到的玻璃仪器有_________、_________。
(3)若FeSO4标准溶液部分变质,会使NOx含量测定结果_________(填“偏高” 、“偏低”或“无影响 ”)。
(4)标准状况下该工厂烟道气中NOx(折合成NO2)的含量为_________mg·m3(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列情况会使所配溶液浓度偏低或其它测量值偏低的是( )
①滴定实验中配制标准碱液时,所用砝码生锈
②用滴定管量取a.00mL液体时,开始时平视读数,结束时俯视读数
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④在用标准液(已知浓度)滴定未知溶液时,标准液滴定管水洗未润洗
⑤定容时,仰视容量瓶的刻度线
⑥在用标准液(已知浓度)滴定未知溶液时,滴定前无气泡滴定后有气泡
⑦滴定前有气泡,滴定终点无气泡
⑧用蒸馏水洗净锥形瓶后盛入待测NaOH溶液进行滴定
A. ①③⑤⑥B. ①②⑤⑦C. ②③④⑧D. ③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com