
【题目】烟道气的主要成分为粉尘、空气、H2O、NOx,其中NOx是主要的大气污染物之一,为了监测某工厂烟道气中NOx含量,采集标准状况下50.00 L烟道气样经除尘、干燥后缓慢通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO3,除去多余的H2O2并加水稀释至100.00 mL。量取20.00 mL该溶液,加入30.00 mL 0.01000 mol·L1FeSO4标准溶液(过量),充分反应后,用0.001000 mol·L1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液10.00 mL。滴定过程中发生如下反应:
Fe2+ + NO3 + H+ — NO↑ + Fe3+ + H2O (未配平)
![]() + Fe2+ + H+ — Cr3+ + Fe3++ H2O (未配平)
+ Fe2+ + H+ — Cr3+ + Fe3++ H2O (未配平)
(1)NO被H2O2氧化为NO3的离子方程式是_________。
(2)配制100mL 0.001000 mol·L1 K2Cr2O7标准溶液时,除需用到烧杯、量筒、玻璃棒外,还需用到的玻璃仪器有_________、_________。
(3)若FeSO4标准溶液部分变质,会使NOx含量测定结果_________(填“偏高” 、“偏低”或“无影响 ”)。
(4)标准状况下该工厂烟道气中NOx(折合成NO2)的含量为_________mg·m3(写出计算过程)。
【答案】2NO+3H2O2=2H++2NO![]() +2H2O 胶头滴管 100mL容量瓶 偏高 368 mg·m3
+2H2O 胶头滴管 100mL容量瓶 偏高 368 mg·m3
【解析】
(1)NO被H2O2氧化为NO3,H2O2被还原为H2O,据此写出反应的离子方程式;
(2)配制一定浓度的溶液,需用到烧杯、量筒、玻璃棒、胶头滴管、100mL容量瓶,据此进行解答。
(3)若FeSO4标准溶液部分变质,则消耗K2Cr2O7溶液的体积减小,计算时求得NO3-的物质的量增大,会使NOx含量测定结果偏高;
(4)根据![]() +6 Fe2+ + 14H+ =2Cr3+ + 6Fe3++7 H2O、3Fe2+ + NO3 + 4H+ = NO↑ + 3Fe3+ +2 H2O反应中各量之间的关系进行计算。
+6 Fe2+ + 14H+ =2Cr3+ + 6Fe3++7 H2O、3Fe2+ + NO3 + 4H+ = NO↑ + 3Fe3+ +2 H2O反应中各量之间的关系进行计算。
(1)NO被H2O2氧化为NO3,H2O2被还原为H2O,反应的离子方程式是2NO+3H2O2=2H++2NO![]() +2H2O;
+2H2O;
答案为:2NO+3H2O2=2H++2NO![]() +2H2O;
+2H2O;
(2)配制100mL 0.001000 mol·L1 K2Cr2O7标准溶液时,除需用到烧杯、量筒、玻璃棒外,还需用到的玻璃仪器有胶头滴管、100mL容量瓶;
答案为:胶头滴管、100mL容量瓶;
(3)若FeSO4标准溶液部分变质,则消耗K2Cr2O7溶液的体积减小,计算时求得NO3-的物质的量增大,会使NOx含量测定结果偏高;
答案为:偏高;
(4)根据反应![]() +6 Fe2+ + 14H+ =2Cr3+ + 6Fe3++7 H2O
+6 Fe2+ + 14H+ =2Cr3+ + 6Fe3++7 H2O
1mol 6mol
5×10-5mol 3×10-4mol
3Fe2+ + NO3 + 4H+ = NO↑ + 3Fe3+ +2 H2O
3mol 1mol
15×10-4mol-3×10-4mol 4×10-4mol
标准状况下该工厂烟道气中NOx(折合成NO2)的含量为![]() =368mg·m3;
=368mg·m3;
答案为:368。


科目:高中化学 来源: 题型:
【题目】Ⅰ.工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。从工业废水中回收硫酸亚铁和金属铜的工艺流程如图所示。
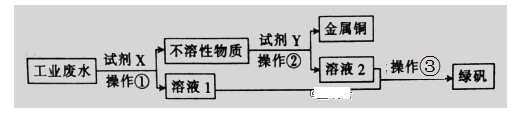
(1)操作③的名称为__________ 。
(2)试剂X为__________(填化学式),操作②涉及的离子反应方程式为__________ 。
Ⅱ.(3)研究表明:多种海产品如虾、蟹、牡蛎等,体内含有+5 价砷(As)元素,但它对人体是无毒的,砒霜的成分是 As2O3,属剧毒物质,专家忠告:吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:大量海鲜+大量维生素 C=砒霜。该使人中毒过程中维生素 C 是________(填“氧化剂”或“还原剂)
(4)已知某反应中反应物和生成物有:KMnO4、H2SO4、MnSO4、H2C2O4、K2SO4、H2O和一种未知物X。
①若0.5 molH2C2O4在反应中失去1 mol电子生成X,则X的化学式为__________ 。
②将氧化剂和还原剂及配平的系数填入下列方框中,并用单线桥标出电子转移的方向和 数目。__________
![]()
③若已知H2C2O4为弱酸,试写出该反应的离子方程式:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“共生系统”能很大程度上提高经济效益。研究硫酸工业尾气的“共生系统”具有重要意义。回答下列问题:
(1)工业上,将Na2CO3和Na2S以合适的物质的量比配成溶液,吸收富集的SO2,可制取重要的化工原料Na2S2O3,同时放出CO2。该反应的化学方程式为___________________。
(2)工业上,将富含SO2的工业尾气降温液化,收集液态SO2。用液态SO2、硫磺(用S表示)、液氯为原料,在200℃~250℃活性炭催化条件下合成氯化剂SOCl2。该反应中氧化剂与还原剂的物质的量之比为________________。
(3)SOCl2分子的空间构型为______________。下列关于O、S、Se三种同主族元素的叙述正确的是____________(填序号)。
a.沸点:H2O>H2S>H2Se
b.H2O分子中H—O—H键的键角小于H2S分子中H—S—H键的键角
c.热稳定性H2O>H2S>H2Se
d.CS2是一种直线型分子,分子中C、S原子都满足8电子稳定结构
(4)氯化亚砜(SOCl2,易挥发液体,易水解)常用作脱水剂。ZnCl2·xH2O制取无水ZnCl2流程如图所示:
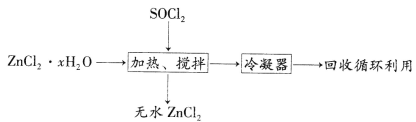
①利用SOCl2和ZnCl2·xH2O混合加热可制得无水ZnCl2的原因是_________________________________(用化学方程式和必要的文字解释)。
②甲同学认为SOCl2也可用于FeCl3·6H2O制取无水FeCl3,但乙同学认为该过程会发生氧化还原反应。要验证乙同学观点是否正确,可选择下列试剂中的___________(填序号)。
a.K3[Fe(CN)6]溶液 b.BaCl2溶液和稀盐酸
c.AgNO3溶液和稀硝酸 d.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为___,该能层具有的原子轨道数为___。
(2)BF3与一定量的水形成(H2O)2BF3晶体Q,Q在一定条件下可转化为R:

晶体Q中各种微粒间的作用力有______(填序号)。
a.离子键 b.共价键 c.配位键 d.氢键
(3)第一电离能I1(Zn)___I1(Cu)(填“大于”或“小于”),原因是______。
(4)Ti晶体的原子堆积方式为六方堆积(如图所示),则晶体中Ti原子的配位数是___,某Ti配合物的化学式是[Ti (H2O)5Cl]Cl2·H2O,1 mol该配合物中含配位键的数目是___。
![]()
(5)石墨烯(如图a)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图b)。
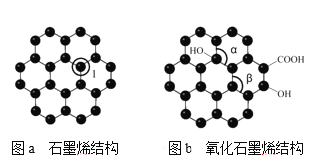
图a中,1号C与相邻C形成σ键的个数为____,图b中键角α___键角β。(填“>”、“<”或“=” );若将图b所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有_____(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究氢氧化铝的两性,最适宜的试剂是( )
A.AlCl3、氨水、稀盐酸B.![]() 、氨水、稀盐酸
、氨水、稀盐酸
C.Al、NaOH溶液、稀盐酸D.![]() 溶液、NaOH溶液、稀盐酸
溶液、NaOH溶液、稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )

A.反应①②③④⑤均属于氧化还原反应,反应③还属于置换反应
B.反应⑤说明该条件下铝可用于制熔点较高的金属
C.相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶1
D.反应①中氧化剂与还原剂的物质的量之比为1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:
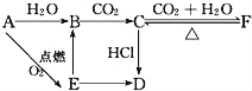
(1)写出A、B、C、D、E、F的化学式:
A.___,B.___,C.___,D.___,E.___,F.___。
(2)写出有关反应的化学方程式(是离子反应的直接写离子方程式)。
A→E:___,
E→B:___,
F→C:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是( )
A. 现有CO、CO2、O3三种气体,它们分别都含有1 mol O,则三种气体的物质的量之比为3∶2∶1
B. 28 g CO和22.4 L CO2中含有的碳原子数一定相等
C. 标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32
D. a g Cl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com