
【题目】铜是人类最早使用![]() 金属,在生产生活中应用及其广泛。工业上以黄铜矿 (主要成分FeCuS2)为原料制取金属铜,其主要工艺流程如图所示。
金属,在生产生活中应用及其广泛。工业上以黄铜矿 (主要成分FeCuS2)为原料制取金属铜,其主要工艺流程如图所示。
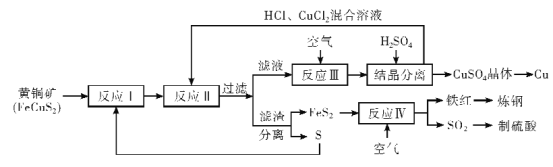
已知:反应II的离子方程式:Cu2++CuS+4Cl-=2[CuCl2]-+S
回答下列问题:
(1)FeCuS2中Fe的化合价__________。
(2)写出一条能使反应I充分进行的措施是_______________________________。
(3)反应III的离子方程式为_________________________________。向反应III后的溶液中加入稀硫酸结晶分离的具体操作为 ____________________。
(4)反应IV的化学方程式为____________________________________。反应IV中,也可以氨水吸收尾气SO2再制成化学肥料,写出氨水吸收SO2的化学方程式_________________
(5)该流程中,可循环利用的物质除CuCl2外,还有___________________(填化学式)。
【答案】+2 粉碎黄铁矿,或其他合理答案 4[CuCl2]-+O2+4H+=4Cu2++8Cl-+2H2O 蒸发浓缩冷却结晶过滤 4FeS2+11O2![]() 2Fe2O3+8SO2 2NH3 H2O +SO2=(NH4)2SO3 + H2O(或其他合理答案) HCl S H2SO4
2Fe2O3+8SO2 2NH3 H2O +SO2=(NH4)2SO3 + H2O(或其他合理答案) HCl S H2SO4
【解析】
在工艺流程中,反应Ⅰ为FeCuS2与S反应,生成FeS2和CuS;反应Ⅱ为CuS与CuCl2、HCl反应,Cu2++CuS+4Cl-=2[CuCl2]-+S;反应Ⅲ为[CuCl2]-与O2反应,生成CuCl2和HCl;反应Ⅳ为FeS2与O2反应,生成Fe2O3和SO2。
(1)FeCuS2中Cu显+2价,S显-2价,则Fe的化合价+2。答案为:+2;
(2)能使反应I充分进行的措施是粉碎铁矿石,或不断搅拌固体混合物;
(3)反应III的离子方程式为4[CuCl2]-+O2+4H+=4Cu2++8Cl-+2H2O;向反应III后的溶液中加入稀硫酸,将一部分CuCl2转化为CuSO4和HCl,结晶分离的具体操作为蒸发浓缩、冷却结晶、过滤。答案为:蒸发浓缩、冷却结晶、过滤;
(4)反应IV的化学方程式为4FeS2+11O2![]() 2Fe2O3+8SO2;反应IV中,也可以氨水吸收尾气SO2再制成化学肥料,氨水吸收SO2的化学方程式:2NH3 H2O+SO2=(NH4)2SO3+H2O。
2Fe2O3+8SO2;反应IV中,也可以氨水吸收尾气SO2再制成化学肥料,氨水吸收SO2的化学方程式:2NH3 H2O+SO2=(NH4)2SO3+H2O。
(5)该流程中,可循环利用的物质除CuCl2外,还有HCl、S、H2SO4。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的两种元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)X与L形成的常见阴离子的电子式为____________________。
(2)Z、X两元素按原子数目比1:3和2:4构成分子A和B,用电子式表示A的形成过程______,B的结构式_______________________。
(3)硒是人体必须的微量元素,与L同一主族,硒原子比L原子多两个电子层,则硒在周期表的位置为_______________,其最高价氧化物水化物的化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下反应①NH3+H+![]() NH
NH![]() (平衡常数为K1),②Ag++Cl-
(平衡常数为K1),②Ag++Cl-![]() AgCl(平衡常数为K2),③Ag++2NH3
AgCl(平衡常数为K2),③Ag++2NH3![]() Ag(NH3)
Ag(NH3)![]() (平衡常数为K3)。
(平衡常数为K3)。
①、②、③的平衡常数关系为K1>K3>K2,据此所做的以下推测合理的是
A.氯化银不溶于氨水
B.银氨溶液中加入少量氯化钠有白色沉淀
C.银氨溶液中加入盐酸有白色沉淀
D.银氨溶液可在酸性条件下稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):
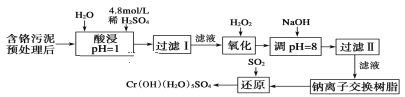
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | - | - | 4.7 | - |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是___(写一条即可)。
(2)调pH=8是为了除去___(填Fe3+、Al3+、Ca2+、Mg2+)。
(3)试配平氧化还原反应方程式:_Na2Cr2O7+_SO2+_H2O=________Cr(OH)(H2O)5SO4+_Na2SO4;每生成1molCr(OH)(H2O)5SO4消耗SO2的物质的量为___。
(4)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+ 和Fe2+的实验步骤:①___;②___;③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种医药中间体,其结构简式如图所示。下列有关化合物X的说法正确的是( )

A.分子中的所有碳原子可能处于同一平面
B.在酸性条件下的水解产物能与FeCl3显色
C.不能与NaHCO3溶液反应
D.1mol化合物X最多能与2mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列提供的一组物质回答问题:
①NH4Cl ②MgCl2 ③H2S ④Na2O2 ⑤MgO ⑥Cl2 ⑦NaOH
(1)仅含有共价键的是_________;既有离子键又有共价键的是_________(用序号表示)
(2)离子化合物有_____________________;(用序号表示)
(3)Na2O2 的电子式_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
G是一种神经保护剂的中间体,某种合成路线如下:
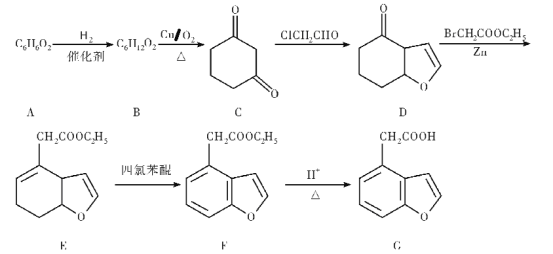
根据上述转化关系,回答下列问题:
(1)芳香族化合物A的名称是___________。
(2)F中含氧官能团的名称是___________。
(3)B→C的反应类型为_______________。
(4)F→G的反应方程式为___________________________。
(5)G的同分异构体能同时满足下列条件的共有__________________种(不含立体异构);
①芳香族化合物②能发生银镜反应,且只有一种官能团,③核磁共振氢谱显示为4组峰,且峰面积比为1:2:2:3。请写出其中任意一种的结构简式_______________________。
(6)参照上述合成路线,写出以![]() 和BrCH2COOC2H5为原料(无机试剂任选),制备
和BrCH2COOC2H5为原料(无机试剂任选),制备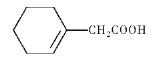 的合成路线____________。
的合成路线____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】17.4g MnO2与240 mL 10 mol/L(密度为1.10g/mL)的盐酸(足量)混合加热(不考虑盐酸挥发),使其充分反应后,再向溶液中加入足量的AgNO3溶液。(已知:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O)
MnCl2+Cl2↑+2H2O)
试求:(1)10 mol/L的盐酸的质量分数____________
(2)产生的气体在标准状况下的体积______________;
(3)产生沉淀的质量_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个绝热的、容积固定的密闭容器中,发生可逆反应mA(g)+nB(g)![]() pC(g)+qD(g)(m、n、p、q为任意正整数)。下列能说明该可逆反应达到平衡状态的是( )
pC(g)+qD(g)(m、n、p、q为任意正整数)。下列能说明该可逆反应达到平衡状态的是( )
①混合气体的密度不再发生变化 ②体系的温度不再发生变化 ③A的转化率不再改变 ④各组分的百分含量不再改变 ⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
A. ②③④B. ①③⑤C. ②④⑤D. ①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com