
����Ŀ��[��ѧ����ѡ��5���л���ѧ����]
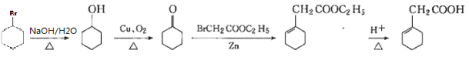
G��һ�����������м��壬ij�ֺϳ�·�����£�
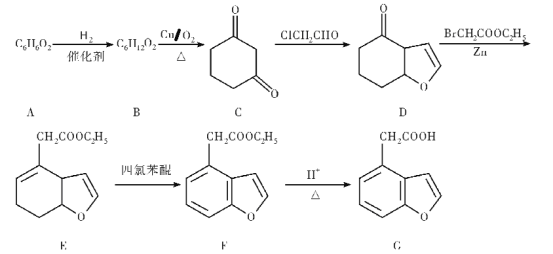
��������ת����ϵ���ش��������⣺
��1�������廯����A��������___________��
��2��F�к��������ŵ�������___________��
��3��B��C�ķ�Ӧ����Ϊ_______________��
��4��F��G�ķ�Ӧ����ʽΪ___________________________��
��5��G��ͬ���칹����ͬʱ�������������Ĺ���__________________�֣����������칹����
�ٷ����廯������ܷ���������Ӧ����ֻ��һ�ֹ����ţ��ۺ˴Ź���������ʾΪ4��壬�ҷ������Ϊ1��2��2��3����д����������һ�ֵĽṹ��ʽ_______________________��
��6�����������ϳ�·�ߣ�д����![]() ��BrCH2COOC2H5Ϊԭ�ϣ����Լ���ѡ�����Ʊ�
��BrCH2COOC2H5Ϊԭ�ϣ����Լ���ѡ�����Ʊ�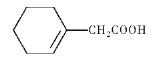 �ĺϳ�·��____________��
�ĺϳ�·��____________��
���𰸡��䱽���ӣ���1��4-�����ӣ� �����Ѽ� ������Ӧ  3
3 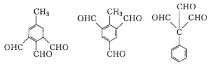
��������
��ΪA�Ƿ����廯�����A�����бغ��б������ٲ���C�Ľṹ����ȷ��A�Ľṹ��ʽΪ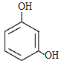 ��B�Ľṹ��ʽΪ
��B�Ľṹ��ʽΪ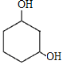 ��
��
��1�������廯����A�������Ǽ䱽���ӣ���1,4-�����ӣ���
��2��F�к��������ŵ��������������Ѽ���
��3��B��C�ķ�Ӧ����Ϊ������Ӧ��
��4��F��G�ķ�Ӧ����ʽΪ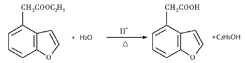 ��
��
��5��G��ͬ���칹��߱�����������
�ٷ����廯���˵�������к��б�����
���ܷ���������Ӧ����ֻ��һ�ֹ����ţ����������Oԭ�ӹ�����ͬ�Ĺ����ţ�ֻ��Ϊ����ȩ������̼ԭ�������ǣ�ȥ��һ������������ȩ������һԭ����Ϊ����
�ۺ˴Ź���������ʾΪ4��壬�ҷ������Ϊ1��2��2��3������ӽṹ�����ܶԳơ�
G��ͬ���칹����ͬʱ�������������Ĺ�������3�֣�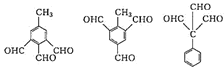 ��
��
��6����![]() ��BrCH2COOC2H5Ϊԭ�ϣ��Ʊ�
��BrCH2COOC2H5Ϊԭ�ϣ��Ʊ�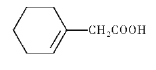
��Ҫʹ��������D��E��ת������Ҫ������һ�㣬���轫![]() ת��Ϊ
ת��Ϊ![]() ���Ӷ��ó��ϳ�·��Ϊ��
���Ӷ��ó��ϳ�·��Ϊ��
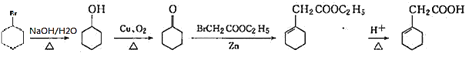 ��
��


 һ����ʦȨ����ҵ��ϵ�д�
һ����ʦȨ����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.��ͼ��һ����ȡ����֤�������ֻ�ѧ���ʵ�ʵ��װ�ã�װ��A��ȡ��������
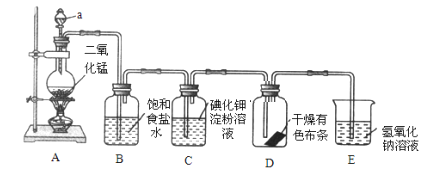
�ش��������⣺
��1����Cl2����ͨ��ʱ��װ��D�и������ɫ�����ܷ���ɫ��Ϊʲô��__��__��
��2����Ҫ֤�������Cl2��Ư���ԣ�����װ��Dǰ����һ��װ��__��ϴ��ƿ��
��3��װ��E��������___���÷�Ӧ�����ӷ���ʽΪ__��
II.����98%��Ũ���ᣨ�ܶ�Ϊ1.84g��cm��3�����Ƴ�Ũ��Ϊ0.5mol��L��1��ϡ����500mL��
��4������Ũ��������Ϊ___mL��
��5��ѡ�õ���Ҫ�����У��ձ�����Ͳ����ͷ�ιܡ���������___��
��6��������ȷ��˳��Ϊ___������ţ���
A������Ͳ��ȡŨ���� B�������ߵ�ҡ�� C���ý�ͷ�ιܼ�ˮ���̶� D�������ƺõ���Һת���Լ�ƿ�����ϱ�ǩ E��ϡ��Ũ���� F������Һת������ƿ
��7����ʵ����������������ȷ��������ʱ���ӿ̶��ߣ���������ҺŨ��___0.5mol��L-1(������������С��������������)��
��8����ͬѧ�ڶ��ݺӸǵ�תҡ�Ⱥ���Һ����ڿ̶��ߣ��ֵμ�����ˮ���̶ȡ���������ҺŨ�ȵ�Ӱ��__(����ƫ��������ƫ����������Ӱ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��Fe(OH)2��Cu(OH)2�ı�����Һ�У����������ӵ����ʵ���Ũ�ȵĸ�����[һlg c(M2+)]����ҺpH�ı仯��ϵ��ͼ��ʾ����֪���¶��£�Ksp[Cu(OH)2]2]������˵����ȷ���� �� ��

A. b�߱�ʾFe(OH)2������Һ�еı仯��ϵ����Ksp[Fe(OH)2]=10-15.1
B. ��Fe(OH)2��Cu(OH)2��������ʱ����Һ�У�C(Fe2+)��C(Cu2+)��1��104.6
C. ��X���Ӧ�ı�����Һ�м�������NaOH����ת��ΪY���Ӧ����Һ
D. ��ȥCuSO4��Һ�к��е�����Fe2+���ɼ�������Cu0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ����������ʹ��![]() ������������������Ӧ�ü���㷺����ҵ���Ի�ͭ�� (��Ҫ�ɷ�FeCuS2)Ϊԭ����ȡ����ͭ������Ҫ����������ͼ��ʾ��
������������������Ӧ�ü���㷺����ҵ���Ի�ͭ�� (��Ҫ�ɷ�FeCuS2)Ϊԭ����ȡ����ͭ������Ҫ����������ͼ��ʾ��
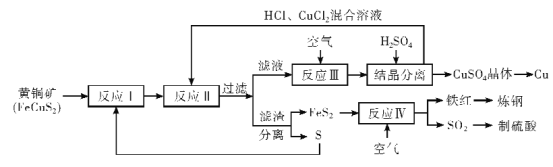
��֪����ӦII�����ӷ���ʽ��Cu2++CuS+4Cl-=2[CuCl2]-+S
�ش��������⣺
��1��FeCuS2��Fe�Ļ��ϼ�__________��
��2��д��һ����ʹ��ӦI��ֽ��еĴ�ʩ��_______________________________��
��3����ӦIII�����ӷ���ʽΪ_________________________________����ӦIII�����Һ�м���ϡ����ᾧ����ľ������Ϊ ____________________��
��4����ӦIV�Ļ�ѧ����ʽΪ____________________________________����ӦIV�У�Ҳ����ˮ����β��SO2���Ƴɻ�ѧ���ϣ�д����ˮ����SO2�Ļ�ѧ����ʽ_________________
��5���������У���ѭ�����õ����ʳ�CuCl2�⣬����___________________���ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڻ�ѧ��Ӧ�У�ֻ�м�����������ƽ�������ߵö�ķ�Ӧ����ӷ�����ײʱ�ſ��ܷ�����ѧ��Ӧ����Щ���ӱ���Ϊ����ӡ�ʹ��ͨ���ӱ�ɻ���������ṩ������ȵ������л�ܣ��䵥λͨ����kJ��mol��1��ʾ��������۲���ͼ��Ȼ��ش����⡣
��1����ͼ����ʾ��Ӧ��________(��������������������)��Ӧ��

��2����֪��1mol H��H����1mol I��I��1mol H��I���ֱ���Ҫ���յ�����Ϊ436kJ��151kJ��299kJ������1mol������1mol �ⷴӦ����HI��____(�����ų�������������)____kJ��������
��3�����з�Ӧ�У����ڷ��ȷ�Ӧ����________���������ȷ�Ӧ����________��
������ȼ�� ��ըҩ��ը ������кͷ�Ӧ �ܶ�����̼ͨ�����ȵ�̼
��ʳ�������������� ��Ba(OH)2��8H2O��NH4Cl��Ӧ ��������ϡ���ᷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij100mL��Һ���ܺ��� Na+��NH4+��Fe3+��CO32����SO42����Cl���е������֣�ȡ����Һ��������ʵ�飬ʵ�������ͼ���������Լ�������������ȫ���ݳ�������˵����ȷ����
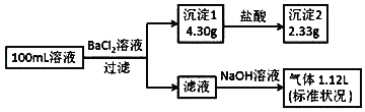
A. ��ԭ��Һ�в����� Na+���� c��Cl������0.1molL��1
B. ԭ��Һ���ܴ��� Cl�� �� Na+
C. ԭ��Һ�� c��CO32������ 0.01molL��1
D. ԭ��Һһ������ CO32����SO42����һ�������� Fe3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��һ�������£�28.80g��������A��1.20molCl2��ɷ�Ӧ������1.20molAClx����x=__________����Aԭ�Ӻ�����������������������Aԭ�Ӻ���������Ϊ__________ ����ԭ�ӽṹʾ��ͼΪ____________��
(2)���а���3.4g���ڱ�״���������Ϊ____________�����е�ԭ�ӵ���ĿΪ_____ ��������ȫ������ˮ�����500mL��Һ������Һ�����ʵ���Ũ��Ϊ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ͭ��Ʒ�к���Zn��Ag��Au�����ʣ���ͼ��ʾ����CH3OH-����ȼ�ϵ�ص������ͭ��Һ���պϵ��K���е�⡣����˵���в���ȷ���ǣ� ��
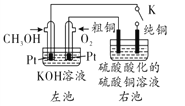
A. ��ظ�����ӦʽΪCH3OH -6e-+8OH-=CO32-+ 6H2O
B. ͨ��һ��ʱ���Ag��Au���ʽ��������ڵ��۵ײ�
C. ����ͭ�缫��������6.4g����ͭ�缫���ش���6.4g
D. ���������ҳش�ͭ�ʹ�ͭ�ֱ�Ϊ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС����̽��һ����ʧ��˵���������θ�����Ŀ���ҩƬ����Ч�ɷ֡����ȣ��������ϵ�֪������ҩͨ��������������ɣ�������Ч�ɷ�Ϊ̼�����ơ�������þ������������̼����е�һ�ֻ��֡�Ȼ�����������ʵ�飺
��.����Ƭ����ҩƬ��ĥ��װ��һ֧�Թ��С�
��.����Թ��м���������ᣬ������ɫ���壮���˺�õ���ɫ��Һ��
��.�ò�˿պȡ��������������Һ���ھƾ������������գ���ɫ���档
��.�����������Һ�еμ�NaOH��Һ��������ɫ������
��ش�
(1)���в�����ɫ��������ӷ���ʽ��____________��
(2)��ͬѧ��ʵ����жϸÿ���ҩƬ��һ������������������ͬѧ��Ϊ����������ͬѧ�жϵ�������________�����ǣ���ͬѧ���ʵ��V����̽����ȡʵ����еİ�ɫ��������һ֧�Թ��У��μ�������NaOH��Һ�����������ܽ⣬��Ӧ�����ӷ���ʽ��__________��
(3)ͨ������ʵ�飬�ó��Ľ����ǣ��ÿ���ҩƬ����Ч�ɷ�Ϊ__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com