
【题目】某兴趣小组欲探究一盒遗失了说明书的治疗胃酸过多的抗酸药片的有效成分。首先,查阅资料得知:抗酸药通常由数种物质组成,其中有效成分为碳酸氢钠、氢氧化镁、氢氧化铝、碳酸钙中的一种或几种。然后进行了如下实验:
Ⅰ.将两片抗酸药片研磨后,装入一支试管中。
Ⅱ.向该试管中加入过量盐酸,产生无色气体.过滤后得到无色溶液。
Ⅲ.用铂丝蘸取少量Ⅱ中所得溶液,在酒精灯外焰上灼烧,无黄色火焰。
Ⅳ.向Ⅱ中所得溶液中滴加NaOH溶液,产生白色沉淀。
请回答:
(1)Ⅱ中产生无色气体的离子方程式是____________。
(2)甲同学由实验Ⅳ判断该抗酸药片中一定含有氢氧化铝,乙同学认为不合理。乙同学判断的依据是________。于是,乙同学设计实验V进行探究:取实验Ⅳ中的白色沉淀于另一支试管中,滴加足量的NaOH溶液,沉淀部分溶解,相应的离子方程式是__________。
(3)通过上述实验,得出的结论是:该抗酸药片的有效成分为__________。
【答案】CaCO3+2H+=Ca2++H2O+CO2![]() 含有Mg(OH)2也会出现同样的现象 Al(OH)3+OH-=AlO2-+2 H2O 氢氧化钙、氢氧化铝和碳酸钙
含有Mg(OH)2也会出现同样的现象 Al(OH)3+OH-=AlO2-+2 H2O 氢氧化钙、氢氧化铝和碳酸钙
【解析】
根据题意,Ⅱ.无色气体是二氧化碳,药品中含有碳酸氢钠和碳酸钙中的一种或两种;Ⅲ.焰色反应没有显示黄色,说明药品中一定没有钠离子,因此不存在碳酸氢钠;Ⅳ. 向Ⅱ中所得溶液中滴加NaOH溶液,产生白色沉淀,白色沉淀可能是氢氧化镁,也可能是氢氧化铝,据此分析解答。
(1)Ⅱ中的无色气体是二氧化碳,可能是碳酸氢钠或者是碳酸钙;由于在酒精灯外焰上灼烧,无黄色火焰,证明没有碳酸氢钠,所以二氧化碳是碳酸钙与盐酸反应生成的,反应离子方程式是:CaCO3+2H+═Ca2++H2O+CO2↑,故答案为:CaCO3+2H+═Ca2++H2O+CO2↑;
(2)由于镁离子也能够和氢氧化钠溶液生成白色沉淀,药品中含有氢氧化镁也会出现同样现象;溶解的沉淀是氢氧化铝,反应的离子方程式是:Al(OH)3+OH-=AlO2-+2H2O,故答案为:含有氢氧化镁也会出现同样现象;Al(OH)3+OH-=AlO2-+2H2O;
(3)根据“取实验Ⅳ中的白色沉淀于另一支试管中,滴加足量的NaOH溶液,沉淀部分溶解”可知,药品中含有氢氧化铝和氢氧化镁,所以药品的有效成分是:氢氧化铝、氢氧化镁、碳酸钙,故答案为:氢氧化铝、氢氧化镁和碳酸钙。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
G是一种神经保护剂的中间体,某种合成路线如下:
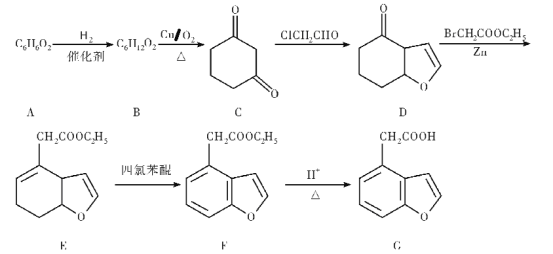
根据上述转化关系,回答下列问题:
(1)芳香族化合物A的名称是___________。
(2)F中含氧官能团的名称是___________。
(3)B→C的反应类型为_______________。
(4)F→G的反应方程式为___________________________。
(5)G的同分异构体能同时满足下列条件的共有__________________种(不含立体异构);
①芳香族化合物②能发生银镜反应,且只有一种官能团,③核磁共振氢谱显示为4组峰,且峰面积比为1:2:2:3。请写出其中任意一种的结构简式_______________________。
(6)参照上述合成路线,写出以![]() 和BrCH2COOC2H5为原料(无机试剂任选),制备
和BrCH2COOC2H5为原料(无机试剂任选),制备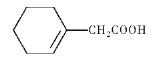 的合成路线____________。
的合成路线____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学完元素周期理论之后,某同学欲探究硫、碳、硅元素非金属性的相对强弱,设计如下'实验:
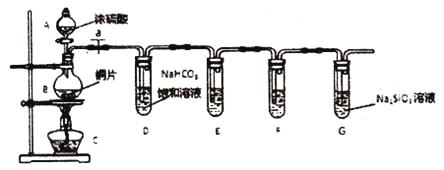
回答下列问题:
(1)填写所示仪器名称:A_________、B___________。
(2)实验步骤:连接仪器、________、加药品后,打开a,然后滴入浓硫酸,加热。烧瓶中反应的化学方程式为___________________________________。
(3)问题探究:
①试管D中发生反应的离子方程式是_________________________。
②甲同学发现装置E中所盛品红溶液颜色无明显变化,F中所盛澄清石灰水变浑浊,据此认定硫元素的非金属性强于碳,而乙同学不同意甲的观点,其理由是_______________________________。
③装置G中出现的实验现象为______________,即可证明碳元素的非金属性强于硅元素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个绝热的、容积固定的密闭容器中,发生可逆反应mA(g)+nB(g)![]() pC(g)+qD(g)(m、n、p、q为任意正整数)。下列能说明该可逆反应达到平衡状态的是( )
pC(g)+qD(g)(m、n、p、q为任意正整数)。下列能说明该可逆反应达到平衡状态的是( )
①混合气体的密度不再发生变化 ②体系的温度不再发生变化 ③A的转化率不再改变 ④各组分的百分含量不再改变 ⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
A. ②③④B. ①③⑤C. ②④⑤D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】位于短周期的四种主族元素A、B、C、D,原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。E是我国使用最早合金中的主要成分。根据你的推断完成下列问题:
(1)B、C、E的元素符号为________,________,__________。
(2)写出由上述元素形成的具有漂白作用的四种物质的化学式______、______、______、______。
(3)由A、B两种元素形成的原子个数比为1∶1的化合物的电子式______。
(4)写出D的最高价氧化物对应水化物与E反应的化学方程式,并用双线桥标出电子转移的方向和数目___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,电子转移发生在同种物质的同种元素之间的是( )
A. 2H2S+SO2=3S+2H2OB. 2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
C. 2KClO3![]() 2KCl+3O2↑D. Cu2O+H2SO4=CuSO4+Cu+H2O
2KCl+3O2↑D. Cu2O+H2SO4=CuSO4+Cu+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,饱和NaCl溶液的密度为ρ g·cm-3,物质的量浓度为c mol·L-1,则下列说法中错误的是( )
A.温度低于20℃时,饱和NaCl溶液的浓度小于c mol·L-1
B.20℃时,饱和NaCl溶液的质量分数为![]() ×100%
×100%
C.20℃时,密度小于ρ g·cm-3的NaCl溶液是不饱和溶液
D.20℃时,饱和NaCl溶液的溶解度S=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 铝粉投入到NaOH溶液中:2Al+2OH-+2H2O══ 2AlO2—+3H2↑
B. AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
C. 三氯化铁溶液中加入铁粉![]()
D. FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《Journal of Energy Chemistry》报导我国科学家设计CO2熔盐捕获与转化装置如图。下列有关说法正确的是
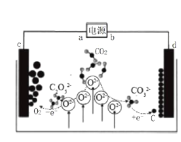
A. b为电源的正极
B. 电子流向:c→a→b→d
C. c极电极反应式为2C2O52――4e-=4CO2+O2
D. 转移0.4mol电子可捕获CO2 2.24L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com