
������A��C12H16O3��������ˮ�⡢�ữ��õ�B��C��C8H8O2����C�ĺ˴Ź������ױ������б������ұ�������2����ԭ�ӡ�B�������з�Ӧ��õ�G��G��̼���⡢������Ԫ����ɣ���Է�������Ϊ172��Ԫ�ط�����������̼55.8 %������7.0 %���˴Ź���������ʾֻ��һ���塣

��֪��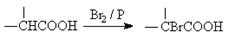
��ش��������⣺
��1��д��G�ķ���ʽ�� ��
��2��д��A�Ľṹ��ʽ�� ��
��3��д��F��G��Ӧ�Ļ�ѧ����ʽ�� ���÷�Ӧ���� ���Ӧ���ͣ���
��4��д����������������C������ͬ���칹�壺 ��
���DZ��Ķ�λ��ȡ�������
������FeCl3��Һ������ɫ��Ӧ��
�۲�����ϩ���� ���ṹ��
���ṹ��
��5����G�Ĵֲ����У�����⺬�оۺ������ʡ�д���ۺ������ʿ��ܵĽṹ��ʽ����Ҫ��д��1�֣��� ��
��1��C8H12O4 ��2��
��3��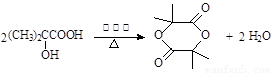 ȡ����Ӧ����������Ӧ��
ȡ����Ӧ����������Ӧ��
��4��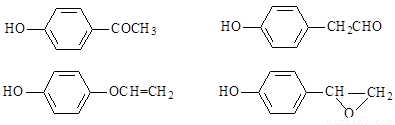
��5��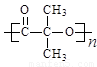
��������
���������������A��C12H16O3��������ˮ�⡢�ữ��õ�B��C��C8H8O2����B�ܶ�����������D��˵��A������B�Ǵ�����C�����ᣬC��C8H8O2���ĺ˴Ź������ױ������б������ұ�������2����ԭ�ӣ���˵����������2��ȡ������������ȡ�������ڶ�λ������C�ķ���ʽ֪��C�ǶԼ������ᣬB�������з�Ӧ��õ�G��G��̼���⡢������Ԫ����ɣ�Ԫ�ط�����������̼55.8%������7.0%������37.2%��̼���⡢��ԭ�Ӹ����ȣ�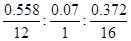 ��2��3��1������Ϊ��Է�������Ϊ172�����������ʽΪC8H12O4���˴Ź���������ʾֻ��һ���壬˵��Gֻ��һ����ԭ�ӣ�B����һϵ�з�Ӧ������F����B��F��̼ԭ�Ӹ�����ͬ���ڼ���Ũ���������������£�F��Ӧ����G����G����������A��C�ķ���ʽ֪��B�Ǻ���4��̼ԭ�ӵ�һԪ����B����������������D��D�����ᣬD���塢P��Ӧ����E�����������Ϣ֪��E�Ǻ�����ԭ�ӵ����ᣬE����ˮ����ữ������F��F�Ǻ����ǻ������ᣬF��������������Ӧ����G����G��ֻ��һ��H������G�Ǻ����������Ļ�����F��2-����2-�ǻ����ᣬE��2-����2-����ᣬD��2-�����ᣬB��2-��������A��
��2��3��1������Ϊ��Է�������Ϊ172�����������ʽΪC8H12O4���˴Ź���������ʾֻ��һ���壬˵��Gֻ��һ����ԭ�ӣ�B����һϵ�з�Ӧ������F����B��F��̼ԭ�Ӹ�����ͬ���ڼ���Ũ���������������£�F��Ӧ����G����G����������A��C�ķ���ʽ֪��B�Ǻ���4��̼ԭ�ӵ�һԪ����B����������������D��D�����ᣬD���塢P��Ӧ����E�����������Ϣ֪��E�Ǻ�����ԭ�ӵ����ᣬE����ˮ����ữ������F��F�Ǻ����ǻ������ᣬF��������������Ӧ����G����G��ֻ��һ��H������G�Ǻ����������Ļ�����F��2-����2-�ǻ����ᣬE��2-����2-����ᣬD��2-�����ᣬB��2-��������A�� ��
��
��1��ͨ�����Ϸ���֪��G�ķ���ʽ��C8H12O4��
��2��ͨ�����Ϸ���֪��A�Ľṹ��ʽΪ ��
��
��3���ڼ��ȡ�Ũ���������������£�F��������������Ӧ����G����Ӧ����ʽΪ�� ��
��
��4�����DZ��Ķ�λ��ȡ�������˵�������Ϻ���2��ȡ������������FeCl3��Һ������ɫ��Ӧ��˵������һ��ȡ�����Ƿ��ǻ����۲�����ϩ����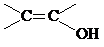 ���ṹ����������������C������ͬ���칹����
���ṹ����������������C������ͬ���칹����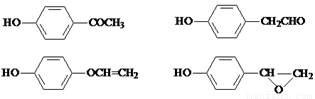 ��
��
��5����G�Ĵֲ����У�����⺬�оۺ������ʣ�F�������Ӽ䷴Ӧ������״�������Ľṹ��ʽΪ��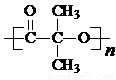 ��
��
���㣺�����л��ﻯѧʽ���ṹ��ʽ���л���Ӧ���͡�ͬ���칹����ж��Լ�����ʽ��д��
�����������Ǹ߿��еij������ͣ������е��Ѷȵ����⡣���������߿����ۺ���ǿ����ע�ض�ѧ������֪ʶ������ѵ����ͬʱ�����ض�ѧ����������������ⷽ����ָ����ѵ�������������ܽ�ȫ��ؿ���ѧ�����л���ѧ����֪ʶ����˼ά����������˼ά���������ѧ����Ӧ�������ʹ���Ч�ʣ�Ҳ����������ѧ������ѧ������֪ʶ��Ǩ������������Ĺؼ��Ǽ�ס���������ŵĽṹ�������Լ�������֮����ת����Ȼ��������������ü��ɡ�ͬʱ��Ҫע���������Ϣ����Ӧ�����й����ŵı仯�жϡ�


 ���㼤�������100�ִ��Ծ�ϵ�д�
���㼤�������100�ִ��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ŨH2SO4 |
| �� |
| �������� |

| �� |
| �� |
| �� |
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�








�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

 ���ֻ��ţ���״�ṹ�����ֻ��ŵ���Ŀ��ϵΪn3=
���ֻ��ţ���״�ṹ�����ֻ��ŵ���Ŀ��ϵΪn3=�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com