
【题目】一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为 ________。
②NO![]() 的空间构型是________ (用文字描述)。
的空间构型是________ (用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。
①根据等电子体原理,CO分子的结构式为________。
②H2O分子中O原子轨道的杂化类型为________。
③CO2的电子式为:________,1 mol CO2中含有的σ键数目为________。
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。 不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为________。
【答案】 1s22s22p63s23p63d5(或[Ar]3d5) 平面三角形 C≡O sp3 ![]() 2×6.02×1023
2×6.02×1023 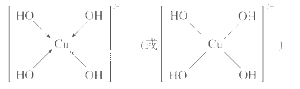
【解析】(1)①Mn的原子序数为25,基态原子的电子排布式为,1s22s22p63s23p63d54s2,则Mn2+基态的电子排布式可表示为1s22s22p63s23p63d5(或[Ar]3d5),故答案为:1s22s22p63s23p63d5(或[Ar]3d5);
②NO3-中N原子形成3个δ键,没有孤电子对,则应为平面三角形,故答案为:平面三角形;
(2)①N2与CO为等电子体,二者结构相似,N2的结构为N≡N,则CO的结构为C≡O,故答案为:C≡O;
②H2O分子中O形成2个δ键,孤电子对数为![]() =2,则为sp3杂化,故答案为:sp3;
=2,则为sp3杂化,故答案为:sp3;
③CO2的结构式为O=C=O,电子式为![]() ,分子中C形成2个δ键,则1molCO2中含有的σ键数目为×6.02×1023个,故答案为:
,分子中C形成2个δ键,则1molCO2中含有的σ键数目为×6.02×1023个,故答案为:![]() ;2×6.02×1023个;
;2×6.02×1023个;
(3)[Cu(OH)4]2-中与Cu2+与4个OH-形成配位键,可表示为 ,故答案为:
,故答案为: 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D 为原子序数依次增大的四种元素,A2和 B+具有相同的电子构型;C、D 为同周期元素,C 核外电子总数是最外层电子数的 3 倍;D 元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是_____(填元素符号),其中 C 原子的外围电子排布图为_____.
(2)单质 A 有两种同素异形体,其中沸点高的是_________(填分子式),原因是_____;A 和 B 的氢化 物所含的化学键类型分别为_____和_____.
(3)C 和 D 反应可生成组成比为 1:3 的化合物 E,E 的立体构型为_____,中心原子的杂化轨 道类型为_____.
(4)化合物 D2A 的立体构型为_____,中心原子的价层电子对数为_____,单质 D与湿润的 Na2CO3 反应可制备 D2A,其化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知35%NaOH溶液的密度为1.38g·cm-3,5%NaOH溶液的密度为1.05g·cm-3,若将上述两种溶液等体积混合,所得NaOH溶液的质量分数是
A. 大于20% B. 等于20% C. 小于20% D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
罗氟司特是用于治疗慢性阻塞性肺病的新型药物,可通过以下方法合成:
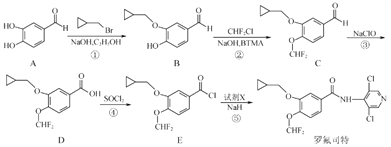
(1)化合物C中的含氧官能团为___________和___________(填名称)。
(2)反应⑤中加入试剂X的分子式为C5H4N2Cl2,则X的结构简式为__________________________。
(3)上述①~④反应中,不属于取代反应的是_______________(填序号)。
(4)写出反应①的化学反应方程式___________________________________。
(5)B的一种同分异构体满足下列条件:
Ⅰ能发生很镜反应,能与FeCl3溶液发生显色反应;
Ⅱ分子中有4种不同化学环境的氢原子。
写出一种该同分异构体的结构简式________________________________。
(6)已知:RBr![]() RNH2根据已有知识并结合相关信息,写出以
RNH2根据已有知识并结合相关信息,写出以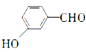 和CH3CH2OH为原料制备
和CH3CH2OH为原料制备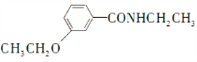 的合成路线流程图(无机试剂任用) ________________________
的合成路线流程图(无机试剂任用) ________________________
合成路线流程图示例如下:
H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期,A基态原子的2p轨道上有2个未成对电子,C的最外层电子数是次外层电子数的3倍,C与D同主族相邻,E位于周期表的ds区,最外层只有一对成对电子。请回答下列问题:
(1)写出各元素符号:A________,B________,C________,D________,E________。
(2)D元素在元素周期表中的位置是_______________,基态E原子的电子占有_____种能量不同的原子轨道。
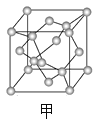
(3)A元素可形成多种单质,其中分子晶体的分子式为________;原子晶体的名称是_______,其每个晶胞(如图甲)实际含有______个A原子;A有一种单质为层状结构的晶体,晶体中存在的作用力有____________,晶体中每个最小环含有_____个原子。
(4)①写出B的单质的电子式___________,化合物AC2的结构式___________。
②用KMnO4酸性溶液吸收DC2气体时,MnO4﹣被还原为Mn2+,该反应的离子方程式为________________________________________________。
(5)D与E能形成化合物X,X的一种晶体晶胞结构如图乙所示,X的化学式为______,D离子的配位数为______;若晶胞边长为a cm,则晶体X的密度计算式为ρ=______________gcm-3(用a和NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 X、Y、Z、W均为短周期元素,他们在元素周期表的位置如下图所示。若Y原子的最外层电子数与电子总数之比为3:4,下列说法正确的是

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 气态氢化物的稳定性:Z>W
D. W的单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com