
| A、c (Ac-)>c (Na+)>c (H+)>c (HAc) |
| B、c (Na+)+c (H+)=c (Ac-)+c (Cl-) |
| C、c (Ac-)=c (Cl-)>c (H+)>c (HAc) |
| D、c (Ac-)>c (Cl-)>c (HAc)>c(H+) |


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
| 选项 | 反应方程式 | 反应类型 | |||
| A | CH4+Br2
| 取代反应 | |||
| B |  +HO-NO2 +HO-NO2
 | 加成反应 | |||
| C | CH3CH2OH+O2
| 氧化反应 | |||
| D | CH2=CH2+HCl
| 取代反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在使用过程中,电池负极区溶液的pH减小 |
| B、使用过程中,电子由Ag20极经外电路流向Zn极 |
| C、Zn是正极,Ag2O是负极 |
| D、Zn电极发生还原反应,Ag2O电极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、棉、麻、丝和毛完全燃烧都是只生成CO2和H2O |
| B、SiO2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆 |
| C、石油裂解、煤的气化、海水制镁、纤维素制火棉等过程中都包含化学变化 |
| D、固态氨基酸主要以内盐形式存在,熔点较高,不易挥发,易溶于有机溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
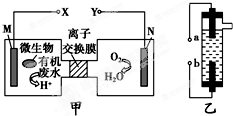 甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能.乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水.下列说法中不正确的是( )
甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能.乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水.下列说法中不正确的是( )| A、装置乙的a极要与装置甲的X极连接 |
| B、装置乙中b极的电极反应式为2Cl--2e-═Cl2↑ |
| C、若有机废水中主要含有葡萄糖,则装置甲中M极发生的电极应为:C6H12O6+6H2O-24e-═6CO2↑+24H+ |
| D、N电极发生还原反应,当N电极消耗5.6 L气体(标准状况下)时,则有2NA个H+通过离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:W>Z>Y>X |
| B、Y 元素在周期表中的位置为第三周期第ⅡA 族 |
| C、丁的稳定性大于甲烷 |
| D、0.1 mol?L-1 甲的水溶液中,由水电离产生的c(H+)=0.1 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纸上层析法通常以滤纸作为惰性支持物,滤纸纤维上的羟基具有亲水性,它所吸附的水作固定相 |
| B、用移液管取25.00mL液体于锥形瓶中时不得将移液管下端深入锥形瓶内 |
| C、实验中不慎将苯酚沾到皮肤上,应立即用酒精洗涤,再用水冲洗 |
| D、将3~4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、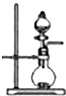 如图可用于实验室制取少量NH3或O2 |
B、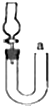 可用从a处加水的方法检验如图装置的气密性 |
C、 实验室可用如图的方法收集Cl2 |
D、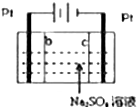 利用如图装置制硫酸和氢氧化钠,其中b为阴离子交换膜、c为阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com