
| A. | 三种溶液pH的大小顺序是:③>②>① | |
| B. | 若将三种溶液稀释相同倍数,pH变化最大的是:③ | |
| C. | 若分别加入50 mL 0.1mol/L盐酸后,pH最大的是:② | |
| D. | 若三种溶液的pH均为9,则溶质物质的量浓度的大小顺序是:③>①>② |
分析 A.等浓度时强碱的pH最大,强碱弱酸盐中对应的酸性越强,水解程度越小;
B.稀释时强碱的变化程度大;
C.根据酸碱混合后溶液中的溶质来分析;
D.三种溶液的pH均为9,c(OH-)=10-5mol/L,c(NaOH)=10-5mol/L,但碳酸的酸性小于醋酸的酸性,所以c(NaHCO3)>c(CH3COONa)>10-5mol/L.
解答 解:A.等浓度时强碱的pH最大,强碱弱酸盐中对应的酸性越强,水解程度越小,碳酸的酸性小于醋酸的,所以三种溶液pH的大小顺序是③>①>②,故A错误;
B.稀释时强碱的变化程度大,所以三种溶液稀释相同倍数,pH变化最大的是③,故B正确;
C.等体积等浓度混合后,①中溶质为NaHCO3、NaCl,②中溶质为NaCl、CH3COOH,③中溶质为NaCl,HCO3-离子水解显碱性,所以pH最大的是①,故C错误;
D.三种溶液的pH均为9,c(OH-)=10-5mol/L,则c(NaOH)=10-5mol/L,但碳酸的酸性小于醋酸的酸性,故NaHCO3的水解程度大于CH3COONa的水解程度,所以c(CH3COONa)>c(NaHCO3)>10-5mol/L,所以三种溶液的pH均为9,则物质的量浓度的大小顺序是②>①>③,故D错误;
故选B.
点评 本题考查盐类水解、pH的计算等,明确酸碱混合的计算,盐类水解的规律、pH与浓度的关系等知识即可解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 元素 | A | B | R | D |
| 相关信息 | 基态原子核外电子占据3个能级且最高能级上有3个电子 | B的单质是最常见半导体材料 | 位于第四周期I B族 | 是非金属元素,其形成的某种单质是电的良导体,有的分子形状似足球 |
| 键能(kJ/mol) | 熔点(K) | 沸点(K) | |
| BO2 | B-O:452 | 1923 | 2503 |
| DO2 | D=O:615,D-O:348 | 216 | 195 |
 ,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氯与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为$(CuC{l}_{3}{)_{n}}^{n-}$.
,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氯与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为$(CuC{l}_{3}{)_{n}}^{n-}$. ( AH3配体作为一个整体写).
( AH3配体作为一个整体写).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100g溶液中含有0.9g NaCl | B. | 100g水中含有0.9g NaCl | ||
| C. | 100g溶液中含有0.9mol NaCl | D. | 100g水中含有0.9mol NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
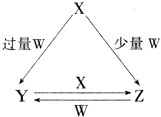 X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(水及部分产物已略去).
X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(水及部分产物已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰毒、麻黄碱 | B. | 海洛因、青霉素 | C. | 冰毒、海洛因 | D. | 黄曲霉素、尼古丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

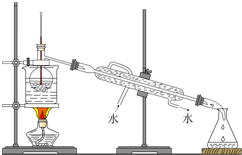
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com