
| A. | 冰毒、麻黄碱 | B. | 海洛因、青霉素 | C. | 冰毒、海洛因 | D. | 黄曲霉素、尼古丁 |
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:填空题
 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种溶液pH的大小顺序是:③>②>① | |
| B. | 若将三种溶液稀释相同倍数,pH变化最大的是:③ | |
| C. | 若分别加入50 mL 0.1mol/L盐酸后,pH最大的是:② | |
| D. | 若三种溶液的pH均为9,则溶质物质的量浓度的大小顺序是:③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
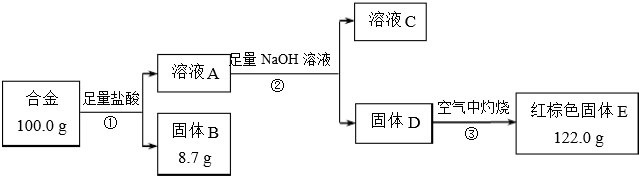
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH3•H2O | B. | Mg(OH)2 | C. | Na2CO3 | D. | MgCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食品添加剂在合理限量范围内使用不影响人体健康 | |
| B. | 食品添加剂必须用天然的物质 | |
| C. | 柠檬黄常用来做着色剂,改善食品色泽 | |
| D. | 醋可用作防腐剂和调味品 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
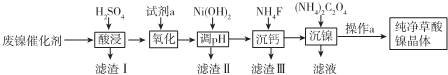
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
| 完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com