
| A、酸雨,二氧化硫 |
| B、温室效应,二氧化碳 |
| C、白色污染,二氧化硅 |
| D、臭氧层空洞,氟氯代烷 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、②④⑤ | B、②⑤⑥ |
| C、②③④⑤ | D、②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Mg+CO2=2MgO+C |
| B、2FeCl3+Fe=3 FeCl2 |
| C、SiO2+2C=Si+2CO↑ |
| D、Mg(OH)2+2HCl=MgCl2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水 |
| B、NaOH溶液 |
| C、K2CO3溶液 |
| D、NaNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大力发展氢能源 |
| B、充分利用太阳能 |
| C、使用含碳能源 |
| D、提高能源利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Li、Na、S |
| B、Na、S、Li |
| C、Na、K、Br |
| D、K、Br、Na |
查看答案和解析>>
科目:高中化学 来源: 题型:
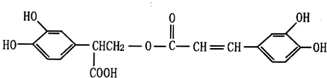
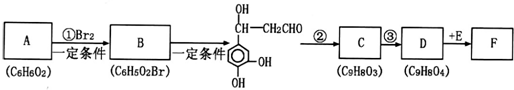
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
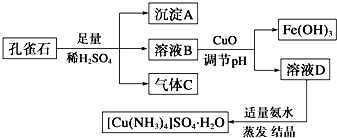
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com