

 N2O4(g)△H<0。
N2O4(g)△H<0。 N2O4(g)△H<0;随反应的不断进行,A容器内压强逐渐变小,B容器内压强不变易使平衡向正反应方向移动,所以A、B中生成的N2O4的速率是V(A)<V(B);由于A容器内气体压强会不断减小,而B容器内气体压强不变,所以,当打开K3时,气球B会变小。
N2O4(g)△H<0;随反应的不断进行,A容器内压强逐渐变小,B容器内压强不变易使平衡向正反应方向移动,所以A、B中生成的N2O4的速率是V(A)<V(B);由于A容器内气体压强会不断减小,而B容器内气体压强不变,所以,当打开K3时,气球B会变小。 N2O4(g)△H<0
N2O4(g)△H<0

科目:高中化学 来源:不详 题型:填空题
 C分别在三种不同实验条件下进行,它们的起始浓度分别为c(A)=0.100mol/L,c(B)=0.200mol/L,c(C)=0.000mol/L。反应物A浓度随时间变化如图所示。
C分别在三种不同实验条件下进行,它们的起始浓度分别为c(A)=0.100mol/L,c(B)=0.200mol/L,c(C)=0.000mol/L。反应物A浓度随时间变化如图所示。
 ①条件下达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。若降温时,请把反应速度变化情况画在图中a~b处。
①条件下达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。若降温时,请把反应速度变化情况画在图中a~b处。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.合成氨的反应温度控制在500℃进行 |
| B.用难溶FeS固体除去工业废水中的Pb2+ |
| C.打开碳酸饮料会有大量气泡冒出 |
| D.实验室用排饱和食盐水的方法收集氯气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.开启啤酒瓶后,瓶中立刻泛起大量泡沫 |
| B.工业合成氨时选择铁做催化剂能极大加快反应速率 |
| C.向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 |
| D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 qZ(g) ΔH>0,m+n>q,在体积一定的密闭容器中达到平衡,下列叙述正确的是
qZ(g) ΔH>0,m+n>q,在体积一定的密闭容器中达到平衡,下列叙述正确的是 | A.反应速率v正(X)=v逆(Y) | B.降低温度,的值变小 |
| C.增加Y的物质的量,X的转化率减小 | D.加入X,反应的ΔH增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2C(g) 达到平衡时保持容器内气体的总物质的量为15 mol。现向反应容器中加6.5 mol A、X mol B、4 mol C。
2C(g) 达到平衡时保持容器内气体的总物质的量为15 mol。现向反应容器中加6.5 mol A、X mol B、4 mol C。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 3H2+N2经5s达到平衡,经测定NH3和H2的浓度均为amol/L,下列叙述中不正确的是
3H2+N2经5s达到平衡,经测定NH3和H2的浓度均为amol/L,下列叙述中不正确的是| A.反应前后的压强比为5:7 | B.达到平衡时NH3的分解率为40% |
C.N2的平衡浓度为 mol/(L·s) mol/(L·s) | D.NH3在5s内的平均速度为 mol/(L·s) mol/(L·s) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 cC(g)+dD(g),右图表示在不同条件下生成物D的体积分数φ(D)随时间变化的关系,据此判断
cC(g)+dD(g),右图表示在不同条件下生成物D的体积分数φ(D)随时间变化的关系,据此判断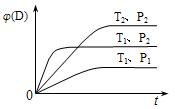
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 10ml 0.01mol/L FeC13溶液和10ml
10ml 0.01mol/L FeC13溶液和10ml  0.01mol/L KSCN溶液,溶液立即变为红色。(1)再向溶液中滴入1mol/LFeC1
0.01mol/L KSCN溶液,溶液立即变为红色。(1)再向溶液中滴入1mol/LFeC1 3溶液,现象 ,平衡 移动,KSCN浓度会 。
3溶液,现象 ,平衡 移动,KSCN浓度会 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com