
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】将30mL 0.5 mol/L NaOH溶液加水稀释到500 mL,稀释后溶液的浓度为( )
A. 0.1 mol/LB. 0.3 mol/LC. 0.05 mol/LD. 0.03 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42﹣、NO3﹣中的几种,若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )
A.溶液中一定不含有CO32﹣ , 可能含有SO42﹣和NO3﹣
B.溶液中的阳离子只有H+、Mg2+、Al3+
C.溶液中n(NH4+)=0.2mol
D.n(H+):n(Al3+):n(Mg2+)=1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去):

请回答下列问题:
(1)A的化学名称是_____________;
(2)B和A反应生成C的化学方程式为_______________________,
该反应的类型为_____________;
(3)D的结构简式为_____________;
(4)F的结构简式为_____________;
(5)D的同分异构体的结构简式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门。下列说法正确的是

A.图Ⅰ中b为纯铜,电解过程中质量减轻,发生的反应为:Cu2++2e-═Cu
B.图Ⅰ中![]() 向a极移动,但不放电
向a极移动,但不放电
C.图Ⅱ中如果a、b间用导线连接时,钢闸门作阴极
D.图Ⅱ中如果a、b间连接直流电源利用外加电流的阴极保护法时,则X必须用锌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)xC(g),符合如图所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,P表示压强).在图中Y轴是指( ) 
①反应物A的转化率
②平衡混合气中物质B的百分含量
③平衡混合气的密度
④平衡混合气的平均摩尔质量.
A.①③
B.②③
C.③④
D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%.
地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以描述分为下列三步(用“C5”表示C5H10O4 , 用“C3”表示C3H6O3):
Ⅰ、H2O(l)═2H+(aq)+ ![]() O2(g)+2e﹣△H=+284kJ/mol
O2(g)+2e﹣△H=+284kJ/mol
Ⅱ、CO2(g)+C5(s)+2H+(aq)═2C3+(s)△H=+396kJ/mol
Ⅲ、12C3+(s)+12e﹣═C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=﹣1200kJ/mol
(1)写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式 .
(2)降低大气中CO2的含量及有效地开发利用CO2 , 目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2 , 一定条件下发生反应:
CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=mol/(Lmin);
②氢气的转化率=;
③该反应的平衡常数表达式为K=;
④下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是 .
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol CO2和3mol H2
⑤当反应达到平衡时,H2的物质的量浓度为c1 , 然后向容器中再加入一定量H2 , 待反应再一次达到平衡后,H2的物质的量浓度为c2 . 则c12的关系(填>、<、=).
(3)减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标.如图2所示甲烷燃料电池就是将电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.将其插入KOH溶液从而达到吸收CO2的目的.请回答:
①通入氧气一极的电极反应式为;
②随着电池不断放电,电解质溶液的pH(填“增大”、“减小”或“不变”).
③通常情况下,甲烷燃料电池的能量利用率(填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率.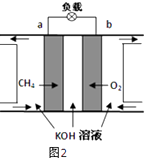
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在国民经济的发展中起着重要作用.
(1)铁在潮湿的空气中易发生电化学腐蚀.某同学将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图1所示.液滴边缘是﹣﹣区(填“正极”或“负极”),其电极反应式为 . 
(2)铁钛合金是一种常用的不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程中发生的反应有;
①2TiO2+(无色)+Fe+4H+═2Ti3+(紫色)+Fe2++2H2O
②Ti3+(紫色)+Fe3++H2O═TiO2+(无色)+Fe2++2H+
③ .
(3)高铁酸钠(Na2FeO4)是一种优良的水处理剂.
①FeO42﹣在水溶液中的存在形态如图2所示,纵坐标表示各存在形态的分数分布.下列说法不正确的是(填字母序号).
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4﹣的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4﹣+OH﹣═FeO42﹣+H2O
②从环境保护的角度看,制备高铁酸盐的较好方法为电解法.用铁片作阳极,NaOH溶液为电解质溶液,电解制备高铁酸钠,其电流效率可达到40%.写出阳极的电极反应式
. 铁丝网电极是更理想的阳极材料,相同条件下,可将电流效率提高至70%以上,原因是 .
若维持电流强度为5.0A,电解20min,理论上可生成Na2FeO4g.(己知:F=96500C/mol,答案保留两位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com