
����Ŀ��֤��±��Ԫ�صķǽ�����ǿ����ijС������ͼ��ʾװ�ý���ʵ��(�г���������ȥ���������Ѽ��)��
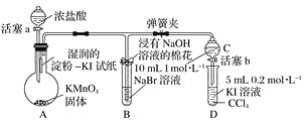
ʵ����̣�
��.���ɼУ�����a���μ�Ũ���ᡣ
��.��B��C�е���Һ����Ϊ��ɫʱ���н����ɼС�
��.��B����Һ�ɻ�ɫ��Ϊ�غ�ɫʱ���رջ���a��
��.����
(1)��֤������������ǿ�ڵ��ʵ��������________________________________________��
(2)B����Һ������Ӧ�����ӷ���ʽ��____________________________________________��
(3)Ϊ��֤���������ǿ�ڵ⣬���� �� �IJ�����������____________________________��
(4)���̢�ʵ���Ŀ����________________________________________________________��
(5)�ȡ��塢�ⵥ�ʵ�������������ԭ��ͬ����Ԫ�ش��ϵ��£�ԭ�Ӱ뾶��________���õ���������________��
���𰸡���1�� KI������ֽ���� ��2��Cl2��2Br����Br2��2Cl��
��3������b��������C����Һ����D�У��رջ���b��ȡ��D����ֹ��CCl4����Һ��Ϊ�Ϻ�ɫ
��4��ȷ��C�Ļ�ɫ��Һ����Cl2���ų�Cl2�����û���ʵ��ĸ���
��5������,����
��������
���⣨1����֤������������ǿ�ڵ��ʵ��������KI������ֽ������Cl2��2I��=2Cl����I2,I2�����۱���ɫ��
��2)B����Һ������Ӧ�����ӷ���ʽ��Cl2��2Br-��Br2��2Cl-
��3��Ϊ��֤���������ǿ�ڵ⣬���� �� �IJ����������Ǵ���b��������C����Һ����D�У��رջ���b��ȡ��D����ֹ��CCl4����Һ��Ϊ�Ϻ�ɫ�������Ϻ�ɫΪI2�ܽ���CCl4���ֵ���ɫ��
��4) ������ʵ���Ŀ����ȷ��C�Ļ�ɫ��Һ����Cl2���ų�Cl2�����û���ʵ��ĸ��š�
��5���ȡ��塢�ⵥ�ʵ�������������ԭ��ͬ����Ԫ�ش��ϵ���,ԭ�Ӱ뾶�����õ�������������


 ��������ϵ�д�
��������ϵ�д� ��ӡ�Ļ���ʱ����ϵ�д�
��ӡ�Ļ���ʱ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����������(��Ҫ�ɷ�����������������������)Ϊԭ��ұ�����Ĺ����������£�
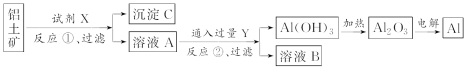
����������ȷ���ǣ� ��
A. ��Ӧ�����Լ�X������������Һ
B. �Լ�Y��HCl������AlO![]() ��Ӧ������������
��Ӧ������������
C. ͼ����ʾת����Ӧ�а���2��������ԭ��Ӧ
D. ��X��Y�Լ����жԻ������տ��Դﵽ��ͬ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ǵӻƻ�������ȡ��һ����ɫ��״���壬˫���������������ص���Ҫ�������ű����Ч���������أ���ش��������⣺
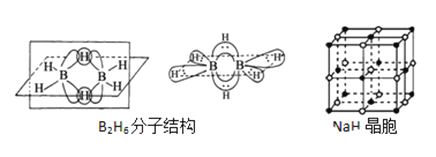
��1����������ص�����Ԫ�ص縺���ɴ�С������__________��������̬Oԭ�ӵļ۵����Ų�ͼ__________��
��2��һ�������ط����к���_______������̼ԭ�ӡ�
��3��˫�������صĺϳ�һ���������⻯��(NaBH4)��ԭ�����أ����⻯��ĺϳɷ����У� 2LiH+B2H6=2LiBH4�� 4NaH+BF3�TNaBH4+3NaF
��д��BH4���ĵȵ�����_________�����ӡ����Ӹ�дһ�֣���
��B2H6���ӽṹ��ͼ��2��Bԭ�Ӻ�һ��Hԭ�ӹ���2�������γ�3���Ķ����Ӽ����м��2����ԭ�ӱ���Ϊ������ԭ����������������2��Bԭ�ӣ���B2H6��������______�ֹ��ۼ���
��NaBH4����������һ��Bԭ�����γ�4�����ۼ���������ʯ(Na3AlF6)����������һ��Alԭ�ӿ����γ�6�����ۼ���ԭ����______________��
��NaH�ľ�����ͼ����NaH�����������ӵ���λ����_________���辧��������������Ϊ����������ǡ�����У������������ӵİ뾶��![]() =__________�ɴ˿�֪�������ӵİ뾶���Ǿ������Ӿ���ṹ����Ҫ���أ���Ƽ������أ�����֮��Ӱ�����Ӿ���ṹ�����ػ���_________��_________��
=__________�ɴ˿�֪�������ӵİ뾶���Ǿ������Ӿ���ṹ����Ҫ���أ���Ƽ������أ�����֮��Ӱ�����Ӿ���ṹ�����ػ���_________��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(һ)������ͭˮ��Һ�м��백ˮ��������������������Ӱ�ˮ���������ܽ⣬����������Һ����ɫ��ԭ�����Լ���õ���һ�ֺ�2+����Һ�������ӵ�����ṹ��ͼ��ʾ��4��NH3��Cu2+���棬��H2O��Cu2+��H2O���ߴ�ֱ������ش��������⣺
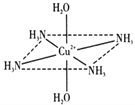
(1)����ͭˮ��Һ�Ӱ�ˮ�ı仯���̣������ӷ���ʽ��ʾΪ��������ɫ��Һ��__________��
(2)������ɫ��������Cu2+��H2O��NH3�γɵ���________��������ͼ�б�ʾ�˻�ѧ��________��������ɫ���ӵĿռ�ṹ��________�Σ�
���������������ᆳ�Ȼ����������Ȼ����ǹ�ҵ�����Ȼ���ij��÷�����Cl2��CCl4�dz��õ��Ȼ������磺Na2O��Cl2��2NaCl��O2��CaO��Cl2��CaCl2��O2��SiO2��2CCl4��SiCl4��2COCl2��Cr2O3��3CCl4��2CrCl3��3COCl2����ش��������⣺
�����ͬ���ڵ�����Ԫ�صĻ�̬ԭ�����������������ԭ����ͬ��Ԫ����______����Ԫ�ط��ţ�������һ�ֽ����ľ����ṹ��ͼ��ʾ���þ����к��н���ԭ�ӵ���ĿΪ_____��
��2��COCl2�׳ƹ�����������Cԭ�Ӳ�ȡsp2�ӻ��ɼ�������̼��ԭ��֮�乲�ۼ���____������ţ�
a��2���Ҽ� b��2���м� c��1���Ҽ���1���м�
��3��CaO������ͼ��ʾ��CaO������Ca2������λ��Ϊ_________��CaO�����NaCl�������������з�ʽ��ͬ���侧���ֱܷ�Ϊ��CaO��3401kJmol��1��NaCl��786kJmol��1���������߾����ܲ������Ҫԭ����_____________________________________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�����þ��ֲ���Ҷ����������������Ľ�������ʮ����Ҫ�����á���ش��������}��
��1�����־��������������ɿ��Ŀ�ѧ����Ϊ_________________��
��2��NaBH4��һ����Ҫ�Ĵ������壬�����ӽṹʽΪ______________��
��3��ͼ1��ʾ���������һ����������ʽ�ṹ���仯ѧʽ�ɱ�ʾΪ________________(��n��ʾ��ԭ�ӵĸ���)��
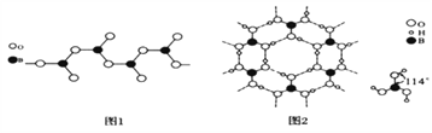
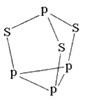
��4�����ᾧ����Ƭ��ṹ������ʯī���ƵIJ�״�ṹ��ͼ2��ʾ��������һ��Ľṹ�����ᾧ���д��ڵ��������й��ۼ���________��________����H3BO3������ӽ�����________(����ĸ)��
A��H4SiO4 B.H3PO4 C��HNO2
���ᾧ������ˮ���ܽ�Ⱥ�С��������ˮ�нϴ�ԭ����____________________��
��5�����������ӣ���ͼ����_________���ӣ�����ԡ���Ǽ��ԣ�����NA��ʾ�����ӵ���������ֵ��0.1mol�����������к��еŵ��Ӷ���Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ��Ϊ����֤���ӡ������̼�������ǿ�����������ͼ��ʾʵ��װ�á�
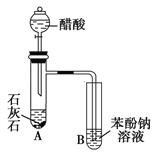
��ش��������⣺
��1������B�е�ʵ������____________________________________________��
��2������B�з�����Ӧ�Ļ�ѧ����ʽ��___________________________��
��3����ʵ����Ʋ����ܣ��������____________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ����������ֶ�����Ԫ�ص�λ����ͼ��ʾ(�����ҡ���������λ��δ���)��
![]()
��֪����Ԫ�ص�ԭ������֮��Ϊ36���ҵ�ԭ��������ס���ԭ������֮����ȡ�
(1)��Ԫ�������ڱ��е�λ��Ϊ______________��
(2)���������γ�AB2�ͻ�����仯ѧʽΪ________��
(3)������Ȼ�����γɻ�������������Ԫ�أ������________(������)���䵥�����Ԫ�ص�����������Ӧˮ�����Ũ��Һ����ʱ��Ӧ�Ļ�ѧ����ʽ��______________________��
(4)���ס��ҡ�����������Ԫ����������ʱ��������������Ԫ�صõ��Ļ�����������࣬����________(��Ԫ�ط���)��д����Щ���������������ַ������������Ļ�ѧʽ______________________
(��ԭ�Ӹ�����Ϊ1��2���ڷ����м۵�������Ϊż��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��һ�ֲ�����ˮ�Ĺ���ǽ������������ͼ�е�ת����ϵ���ش��������⣺
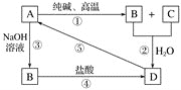
��1��д����ѧʽ��A��____________��D��____________��
��2��д����ط�Ӧ�Ļ�ѧ����ʽ����____________����____________��
��3��д����ط�Ӧ�����ӷ���ʽ����__________����__________����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��L��M����Ԫ�ص�ԭ��������������X��Y��Z��L����ɵ����ʵĻ���Ԫ�أ�M�ǵؿ��к�����ߵĽ���Ԫ�ء�
�ش��������⣺
��1��L��Ԫ�ط���Ϊ________��M��Ԫ�����ڱ��е�λ��Ϊ___________������Ԫ�ص�ԭ�Ӱ뾶�Ӵ�С��˳����_______________(��Ԫ�ط��ű�ʾ)��
��2��Z��X��Ԫ�ذ�ԭ����Ŀ��l��3��2��4���ɷ���A��B��A�ĵ���ʽΪ______��B�Ļ�ѧʽΪ____________,Z��X����Ԫ���γɵ�һ�ּȺ����Ӽ��ֺ����ۼ�����������Ϊ��____________��
��3����(se)������������Ԫ�أ���Lͬһ���壬Seԭ�ӱ�Lԭ�Ӷ��������Ӳ㣬��Se��ԭ������Ϊ_______��������������Ӧ��ˮ�����������ռ���Һ��Ӧ�Ļ�ѧ����ʽΪ____________��1mol���������������ʻ���ʱ��ת�Ƶĵ�����Ϊ____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com