
【题目】微量元素硼和镁对植物的叶的生长和人体骨骼的健康有着十分重要的作用。请回答下列问題:
(1)区分晶体硼和无定形硼最可靠的科学方法为_________________。
(2)NaBH4是一种重要的储氢载体,阴离子结构式为______________。
(3)图1表示多硼酸根的一种无限长的链式结构,其化学式可表示为________________(以n表示硼原子的个数)。
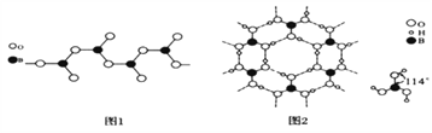
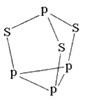
(4)硼酸晶体是片层结构,有与石墨相似的层状结构,图2表示的是其中一层的结构。硼酸晶体中存在的作用力有共价键、________、________。与H3BO3酸性最接近的是________(填字母)。
A.H4SiO4 B.H3PO4 C.HNO2
硼酸晶体在冷水中溶解度很小,但在热水中较大,原因是____________________。
(5)三硫化四磷分子(如图)是_________分子(填“极性”或非极性),用NA表示阿伏加德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为_________。
【答案】 X-射线衔射实验 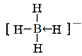 (BO2)nn- 或 BO2- 氢键 范德华力 A 晶体中硼酸分子间以氢键缔合在一起,难以溶解;加热时,晶体中部分氢键被破坏,溶解度增大 极性 NA
(BO2)nn- 或 BO2- 氢键 范德华力 A 晶体中硼酸分子间以氢键缔合在一起,难以溶解;加热时,晶体中部分氢键被破坏,溶解度增大 极性 NA
【解析】分析:(1)根据晶体和非晶体的组成特点分析;
(2)根据阴离子为BH4-分析;
(3)根据均摊法计算化学式;
(4)根据石墨的结构结合硼酸的组成分析;根据含氧酸酸性强弱比较分析;根据氢键对物质性质的影响分析;
(5)根据三硫化四磷分子的结构分析。
详解:(1)区分晶体和非晶体最可靠的科学方法为X-射线衔射实验,因此区分晶体硼和无定形硼最可靠的科学方法为X-射线衔射实验。
(2)NaBH4是一种重要的储氢载体,阴离子为BH4-,含有配位键,结构式为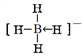 。
。
(3)从图可看出,每个BO32-单元,都有一个B,有一个O完全属于这个单元,剩余的2个O分别为2个BO32-单元共用,所以B:O=1:(1+2×1/2)=1:2,因此化学式为BO2-;
(4)硼酸晶体是片层结构,有与石墨相似的层状结构,又因为氧元素能形成氢键,所以硼酸晶体中存在的作用力有共价键、氢键和范德华力。H3BO3可改写为(HO)3B,非羟基氧原子数为0。A.H4SiO4可改写为(HO)4Si,非羟基氧原子数为0;B.H3PO4可改写为(HO)3PO,非羟基氧原子数为1;C.HNO2可改写为(HO)NO,非羟基氧原子数为1,非羟基氧原子数相同,酸性相近,因此与H3BO3酸性最接近的是原硅酸,答案选A。由于晶体中硼酸分子间以氢键缔合在一起,难以溶解;加热时,晶体中部分氢键被破坏,溶解度增大,所以硼酸晶体在冷水中溶解度很小,但在热水中较大。
(5)三硫化四磷分子结构不对称,属于极性分子;分子中P原子有1对孤对电子、S原子有2对孤对电子,故每个分子含有10对孤对电子,则0.lmol三硫化四磷分子中含有的孤电子对数为NA。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】从1L1 mol/L的NaOH溶液中,取出50mL溶液,该50mL NaOH溶液的物质的量浓度为
A.0.02mol/L B.0.2mol/L C.1 mol/L D.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)湿法制各高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:______________________________
②每生成l mol FeO42-转移__________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为____mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4)原因是__。
(2)工业上从海水中提取单质溴可采用如下方法:
①向海水中通入Cl2将海水中溴化物氧化,其离子方程式为____。
②向上述混合液中吹入热空气,将生成的溴吹出,用纯碱溶液吸收,其化学方程式为__。
③将②所得溶液用H2SO4酸化,使NaBr、NaBrO3中的溴转化为单质溴,再用有机溶剂提取溴后,还可得到副产品Na2SO4。这一过程可用化学方程式表示为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是 ( )


A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是

A. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D. 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】证明卤族元素的非金属性强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。
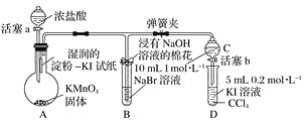
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是________________________________________。
(2)B中溶液发生反应的离子方程式是____________________________________________。
(3)为验证溴的氧化性强于碘,过程 Ⅳ 的操作和现象是____________________________。
(4)过程Ⅲ实验的目的是________________________________________________________。
(5)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,原子半径逐渐________,得电子能力逐渐________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法错误的是( )
A. 18g重甲基(-CD3)中含有的电子数为9NA
B. 22.4L(标准状况)CH2Cl2中含C-H键数为2NA
C. 10g34%H2O2溶液与足量的酸性KMnO4溶液充分反应,转移的电子数为0.2NA
D. 0.1mol由乙烯与乙醇组成的混合物完全燃烧所消托的氧气分子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A的相对分子质量为136,分子式为C8H8O2。A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱和核磁共振氢谱如下图。下列关于A的说法中不正确的是


A. A分子属于酯类化合物,在一定条件下能发生水解反应
B. A在一定条件下可与3 mol H2发生加成反应
C. 与A属于同类化合物的同分异构体只有4种
D. 符合题干特征的A分子结构只有1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
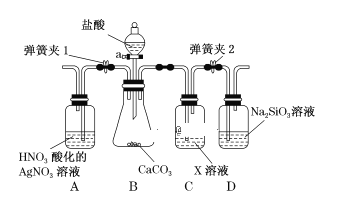
实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,…,关闭活塞a。请回答:
(1)B中反应的离子方程式是_________________________________________。
(2)通过步骤 Ⅰ、 Ⅱ 得知盐酸具有的性质是________(填字母)。
A.挥发性 B.还原性 C.氧化性 D.酸性
(3)C装置的作用是______________,X是____________________(写化学式)。
(4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写的操作和现象是_______________,D中反应的化学方程式是__________________________________。
(5)碳、硅的非金属性逐渐减弱的原因是_____________________(从原子结构角度加以解释)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com