
【题目】软锰矿的主要成分是MnO2,还含有少量金属铁、镁、铝、锌、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上用软锰矿制备碳酸锰并回收硫酸铵,其主要流程如下:
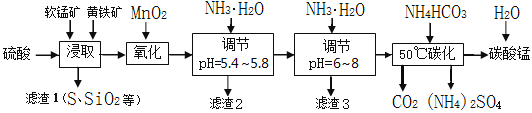
已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
金属离子 | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
开始沉淀pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
完全沉淀pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
(1)提高浸出率的可采取的措施有_________。
A.适当升高温度 B.搅拌 C.加适量纯碱 D.加压
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是____________________________________________。
(3)调节pH为5.4~5.8的目的是_____________________________________________。
(4)滤渣3的主要成分的化学式是_____________。
(5)50℃碳化过程发生反应的离子方程式是____________________________________。
【答案】AB MnO2+FeS2+2H2SO4![]() MnSO4+FeSO4+2S+2H2O使Fe3+、Al3+完全沉淀Cu(OH)22HCO3+Mn2+
MnSO4+FeSO4+2S+2H2O使Fe3+、Al3+完全沉淀Cu(OH)22HCO3+Mn2+![]() MnCO3↓+H2O+CO2↑
MnCO3↓+H2O+CO2↑
【解析】
由流程图可知,浸取时MnO2与FeS2在H2SO4作用下,反应生成MnSO4、FeSO4、S和H2O;氧化时,加入的MnO2在酸性条件下将Fe2+氧化为Fe3+;由表给完全沉淀pH可知,pH为5.4~5.8时,Fe3+、Al3+完全沉淀,pH为6~8时,Cu2+完全沉淀;50℃碳化过程为硫酸锰和碳酸氢铵反应生成碳酸锰、硫酸铵、水和二氧化碳。
(1)为了提高锰元素的浸出率,在“浸取”时可采取的措施有适当升高温度、搅拌、加入足量硫酸等,加入纯碱会减小硫酸浓度,对无气体参加的反应,加压对化学反应速率无影响,故选AB;(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,说明溶液中无Fe3+,即FeS2反应时生成了Fe2+和S,MnO2转化为Mn2+,反应的化学方程式为MnO2+FeS2+2H2SO4![]() MnSO4+FeSO4+2S+2H2O;(3)由表给完全沉淀pH可知,pH为5.4~5.8时,Fe3+、Al3+完全沉淀,则调节pH为5.4~5.8的目的是将Fe3+、Al3+完全沉淀除去;(4)pH为6~8时,Cu2+完全沉淀,则滤渣3的主要成分为Cu(OH)2;(5)50℃碳化得到碳酸锰,碳化过程中硫酸锰和碳酸氢铵反应生成碳酸锰、硫酸铵、水和二氧化碳,反应的化学方程式为:MnSO4+2NH4HCO3=MnCO3+(NH4)2SO4+H2O+CO2↑,则离子方程式为2HCO3+Mn2+
MnSO4+FeSO4+2S+2H2O;(3)由表给完全沉淀pH可知,pH为5.4~5.8时,Fe3+、Al3+完全沉淀,则调节pH为5.4~5.8的目的是将Fe3+、Al3+完全沉淀除去;(4)pH为6~8时,Cu2+完全沉淀,则滤渣3的主要成分为Cu(OH)2;(5)50℃碳化得到碳酸锰,碳化过程中硫酸锰和碳酸氢铵反应生成碳酸锰、硫酸铵、水和二氧化碳,反应的化学方程式为:MnSO4+2NH4HCO3=MnCO3+(NH4)2SO4+H2O+CO2↑,则离子方程式为2HCO3+Mn2+![]() MnCO3↓+H2O+CO2↑。
MnCO3↓+H2O+CO2↑。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)中国古代四大发明之一一黑火火药,它的爆炸反应为;S+2KNO3+3C ![]() 3CO2↑+A+N2↑(已配平)
3CO2↑+A+N2↑(已配平)
①除S外,上列元素的电负性从大到小依次为______.
②在生成物中,A的晶体类型为_______,含极性共价键的分子的中心原子轨道杂化类型为_______.
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为_________.
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为______,Q2+的未成对电子数是________.
(3)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)]6-nx+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)]6-nx++xR-H→Rx[CrCln(H2O)]6-n+xH+交换出来的H+经中和测定,即可求出x和n,确定配离子的组成。将含0.0015mol[CrCln(H2O)]6-nx+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200molL-1NaOH溶液25.00mL,该配离子的化学式为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活密切相关,下列描述正确的是( )
A.液氯是纯净物,具有漂白性
B.碘盐就是在食盐中加入一定量的碘单质
C.氧化钠可以做呼吸面具的供氧剂
D.漂白粉的有效成分是Ca(ClO)2,应密封保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知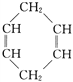 可简写为
可简写为![]() 。现有某化合物W的分子结构可表示为:
。现有某化合物W的分子结构可表示为: ![]() 。
。
(1)W的分子式为________。
(2)W的一氯代物有________种。
(3)下列有关W的说法不正确的是________(填下列选项代码)。
a.能发生加成反应 b.能发生氧化反应
c.能发生加聚反应 d.等质量的W与苯分别完全燃烧所消耗的氧气量,前者大
(4)写出W的芳香族同分异构体(能发生聚合反应)的结构简式:________________,该聚合反应的化学方程式为___________________________________。
(5)W属于________(填下列选项代码)。
a.芳香烃 b.环烃 c.不饱和烃 d.炔烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实对应的结论正确的是
A. 古人精制砒霜过程为:“将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳”,文中涉及的操作方法是升华
B. 据反应:2KClO3+I2=2KIO3+CL2,非金属性:I>Cl
C. 反应SiO2+2C=Si+2CO![]() 高温下才能自发进行,则该反应的△H<0
高温下才能自发进行,则该反应的△H<0
D. 亚硫酰氯(SOCl2)与AlCl3·6H2O混合加热可制得无水AlCl3,因为发生SOCl2+2H2O=2HCl![]() +H2SO4反应,可抑制AlCl3的水解
+H2SO4反应,可抑制AlCl3的水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家设计了利用太阳能作动力,采用特殊电极及可循环利用的强酸性电解质电解二氧化碳和水来制取乙烯的方案,则下列说法错误的是
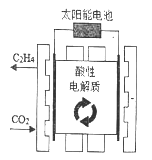
A. 太阳能是新能源,清洁、无污染
B. 电解过程中阳极区附近pH减小
C. 生成乙烯的电极反应为2CO2+12H+-12e-=4H2O+CH2=CH2
D. 通入二氧化碳的一极连接外接电源的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一块部分被氧化为Na2O的钠块10.8g,将其投入足量水中,最终得到1L 0.4mol·L-1的NaOH溶液,则原钠块中钠元素的质量是( )
A.4.6gB.6.2gC.9. 2gD.10.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应可用于焊接钢轨,反应为:2Al + Fe2O3 ![]() 2Fe + Al2O3,下列关于该反应说法正确的是
2Fe + Al2O3,下列关于该反应说法正确的是
A. Al 是还原剂 B. Fe2O3 发生氧化反应
C. Fe 是氧化产物 D. 当生成 1 mol Fe 时,转移 6 mol 电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com