
【题目】化学与生产生活密切相关,下列描述正确的是( )
A.液氯是纯净物,具有漂白性
B.碘盐就是在食盐中加入一定量的碘单质
C.氧化钠可以做呼吸面具的供氧剂
D.漂白粉的有效成分是Ca(ClO)2,应密封保存
科目:高中化学 来源: 题型:
【题目】(题文)(题文)在恒温、恒容条件下,能说明可逆反应:H2(g)+I2(g) 2HI(g)达到平衡状态的是
A. 气体的压强保持不变 B. v(H2)正=2v(HI)逆
C. 气体的密度保持不变 D. 气体的颜色保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家用X射线激光技术观察容器中某反应,各气态反应物粒子在催化剂表面形成化学键过程的示意图如下图所示。下列关于此反应说法错误的是
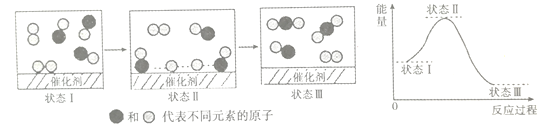
A. 该反应既是化合反应,也是氧化还原反应
B. 该反应是可逆反应,若升高温度,反应物平衡转化率降低
C. 一定条件下达到平衡后,若增大压强,则v(正)、v(逆)均增大,且v(正)>v(逆)
D. 该示意图表明反应物粒子先须断裂所有旧化学键,然后形成新化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁碳混合物处理含CuSO4废水获得金属铜。当休持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时问变化的曲线如图所示。下列推论不合理的是

A. 由图可知,活性炭对Cu2+具有一定的吸附作用
B. 铁屑和活性炭会在溶液中形成微电池,铁屑为负极
C. 利用铁碳混合物回收含CuSO4废水中铜的反应原理:Fe+CuSO4=FeSO4+Cu
D. 增大铁碳混合物中铁碳质量比(x),一定会提高废水中Cu2+的去除速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在水溶液中有四种含铁型体,25℃时,它们的物质的量分数随pH的变化如图所示。下列叙述错误的是
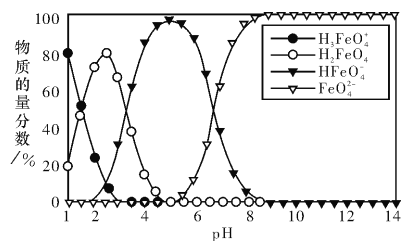
A. 已知H3FeO4+的电离半衡常数分别为:K1=2.5×10-2,K2=4.8×10-4,K3=5.0×10-8,当pII=4吋,溶液中![]()
B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 向pH=5的高铁酸盐溶液中加入KOH溶液,发生反应的离子方程式为HFeO4ˉ+OHˉ=FeO42-+H2O
D. pH=2时,溶液中主要含铁型体浓度的大小关系为c(H2FeO4)>c(H3FeO4+)> c (HFeO4ˉ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿的主要成分是MnO2,还含有少量金属铁、镁、铝、锌、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上用软锰矿制备碳酸锰并回收硫酸铵,其主要流程如下:
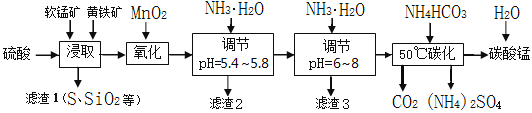
已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
金属离子 | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
开始沉淀pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
完全沉淀pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
(1)提高浸出率的可采取的措施有_________。
A.适当升高温度 B.搅拌 C.加适量纯碱 D.加压
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是____________________________________________。
(3)调节pH为5.4~5.8的目的是_____________________________________________。
(4)滤渣3的主要成分的化学式是_____________。
(5)50℃碳化过程发生反应的离子方程式是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10mL0.1mol·L-1MCl2溶液中滴加 0.1mol·L-1的Na2S溶液,滴加过程中溶液中-lgc(M2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是
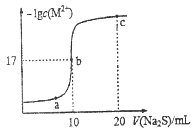
已知:Ksp(NS)=4.0×10-25
A. 该温度下Ksp(MS)=1.0×10-34
B. Na2S溶液中:c(H+)+c(HS-)+c(H2S)=c(OH-)
C. a、b、c三点中,水的电离程度最大的为b点
D. 向NS的悬浊液中加入MCl2溶液,不可能实现NS沉淀转化为MS沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。
锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s),
下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池工作时,电子由负极通过外电路流向正极
C. 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq)
D. 外电路中每通过0.4mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com