
| A.金属原子的核外电子在金属晶体中都是自由电子 |
| B.镁型和铜型的原子堆积方式空间利用率最高 |
| C.金属原子在化学变化中失去的电子数越多,其还原性越强 |
| D.温度升高,金属的导电性将变大 |
科目:高中化学 来源:不详 题型:单选题
| A.熔点1070℃,易溶于水,水溶液导电 |
| B.熔点10.32℃,液态不导电,水溶液导电 |
| C.能溶于CS2,熔点444.6℃ |
| D.熔点3550℃,很硬,不溶于水,不导电 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 表述Ⅰ | 表述Ⅱ |
| A | 在水中,NaCl的溶解度比I2的溶解度大 | NaCl晶体中C1—与Na+间的作用力大于碘晶体中分子间的作用力 |
| B | 通常条件下,CH4分子比PbH4分子稳定性高 | Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小 |
| C | 金属晶体具有良好的延展性 | 金属晶体中的原子层可以发生相对滑动但不会改变原来的排列方式,也不会破坏金属键 |
| D | P4O10、C6H12O6溶于水后均不导电 | P4O10、C6H12O6均属于共价化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
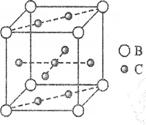
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.某晶体固态不导电,水溶液能导电说明该晶体是离子晶体 |
| B.原子晶体的原子间只存在共价键,而分子晶体内只存在范德华力。 |
| C.区分晶体和非晶体最科学的方法是对固体进行X-射线衍射实验 |
| D.任何晶体中,若含有阳离子也一定含有阴离子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
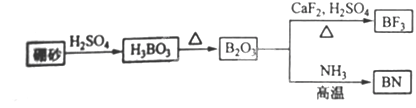
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
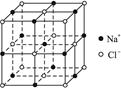
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等于1.06g | B.大于 1.06g 而小于2.86g |
| C.等于2.86g | D.大于2.86g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com