
【题目】已知:乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3)的电离平衡常数为K1=4.5×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)写出水溶液中草酸的电离方程式_____________________________________ 。
(2)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH______________ (填“大”、“小”或“相等”) 。
(3)常温下将0.4mol/L的KOH溶液20mL与0.2mol/L的草酸溶液20mL混合,则混合后溶液中阴离子浓度的大小顺序为_____________________________________ 。
(4)往Na2CO3溶液中加入少量草酸溶液,发生反应的离子方程式为________________。
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入c mol/L的草酸钾溶液20mL后,有草酸钙沉淀生成,则c的最小值为__________________________。
【答案】 H2C2O4HC2O4-+H+、HC2O4-C2O42-+H+ 小 c(C2O42-)>c(OH-)>c(HC2O4-) 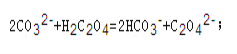 3.2×10-3
3.2×10-3
【解析】(1)酸是二元弱酸存在电离平衡,分步电离,以第一步为主,电离方程式为:H2C2O4![]() H++HC2O4-,HC2O4-
H++HC2O4-,HC2O4-![]() H++C2O42-;故答案为:H2C2O4
H++C2O42-;故答案为:H2C2O4![]() H++HC2O4-,HC2O4-
H++HC2O4-,HC2O4-![]() H++C2O42-;
H++C2O42-;
(2)依据电离平衡常数分析,酸性强弱顺序为:草酸>碳酸>HC2O4->HCO3-,酸性越强,对应盐的水解程度越弱,则相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH小;故答案为:小;
(3)常温下,0.4mol/L的KOH溶液20mL与0.2mol/L的草酸溶液20mL恰好反应生成草酸钠,醋酸根离子易水解而使其溶液呈碱性,但第一步水解大于第二步,两步水解都生成氢氧根离子,所以溶液中阴离子浓度大小顺序是
c(C2O42-)>c(OH-)>c(HC2O4-),故答案为:c(C2O42-)>c(OH-)>c(HC2O4-);
(4)电离平衡常数分析,酸性强弱顺序为:草酸>碳酸>HC2O4->HCO3-;往Na2CO3溶液中加入少量草酸溶液反应生成碳酸氢钠和草酸钠,反应的离子方程式为:2CO32-+H2C2O4=2HCO3-+C2O42-;故答案为:2CO32-+H2C2O4=2HCO3-+C2O42-;
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入c mol/L的草酸钾溶液20mL后,有草酸钙沉淀生成;碳酸钙的Ksp=2.5×10-9=c(Ca2+)c(CO32-),饱和溶液中钙离子浓度c(Ca2+)=5×10-5mol/L,等体积混合后溶液中c(Ca2+)=2.5×10-5mol/L,草酸钙的Ksp=4.0×10-8 =c(Ca2+)c(C2O42-)=2.5×10-5mol/L×![]() mol/L,c=
mol/L,c=![]() =3.2×10-3mol/L,故答案为:3.2×10-3。
=3.2×10-3mol/L,故答案为:3.2×10-3。


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.在鸡蛋清溶液中加入饱和Na2SO4溶液时,会使蛋白质发生变性
B.纤维素在人体内的水解产物是葡萄糖
C.变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应
D.三大合成材料是指塑料、合成纤维和合成橡胶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些电镀厂的酸性废水中常含有一定量的CrO42-和Cr2O72-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法,该法的工艺流程为:
![]()
(1)其中第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O,若平衡体系的pH=12,该溶液显_____色。能说明第①步反应达平衡状态的是______。
Cr2O72-(橙色)+H2O,若平衡体系的pH=12,该溶液显_____色。能说明第①步反应达平衡状态的是______。
a.Cr2O72-和CrO42-的浓度相同 b.溶液的pH值不变
c.溶液的颜色不变 d.2v(Cr2O72-)=v(CrO42-)
(2)写出第②步的离子反应方程式:__________。
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) ![]() Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。
方法2:电解法:该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)写出阳极的电极反应式___________________。
(5)在阴极附近溶液pH升高的原因是(用电极反应解释)___________,溶液中同时生成的沉淀还有______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定实验在化学分析中有重要应用,现用浓度为0.1000molL-1酸性KMnO4标准溶液滴定未知浓度的草酸(H2C2O4):
(1)写出滴定过程中发生反应的离子方程式为 _____________________________________ 。
(2)滴定过程中操作滴定管的图示正确的是 _______________ 。
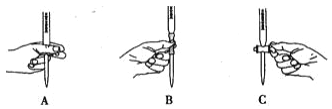
(3)若滴定时滴定管尖嘴部分有气泡,滴定过程中消失,将导致测得的结果_____(选填:“偏大”、“偏小”或“不变”)。
(4)该滴定实验滴定终点的现象是_____________________________________ 。
(5)Na2Cr2O7可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被氧化所需要O2的质量)。现有某水样100.00 mL,酸化后加入C1 mol/L的Na2Cr2O7溶液 V1 mL,使水中的还原性物质完全被氧化(Cr2O72-还原为Cr3+);再用C2mol/L的FeSO4溶液滴定剩余的Cr2O72-,结果消耗FeSO4溶液V2 mL。量取一定体积的Na2Cr2O7溶液时,需要用______(酸式或碱式)滴定管;该水样的COD为___________________________mg/L;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Fe3+、Al3+、Cu2+、Mg2+)

常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | 9.3 | 3.7 | 4.7 | --- |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 6.7 | 9(>9 溶解) |
(1)酸浸时,为了提高浸取效率可采取的措施是____________________(至少写一条)。
(2)加入H2O2 目的是氧化_______离子,其有关的离子方程式______________________。针铁矿(Coethite)是以德国诗人歌德(Coethe)名字命名的,组成元素是Fe、H、O,化学式量为89,其化学式是______________。
(3)调pH=8是为了将_____________离子(从Fe3+、Al3+、Cu2+、Mg2+中选择)以氢氧化物沉淀的形式除去。滤出的沉淀中部分沉淀将溶解于足量的氢氧化钠溶液中,其有关的离子方程式是_____________________________________,取少量上层澄清溶液,向其中通入足量的CO2,又能重新得到相应的沉淀, 其有关的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是
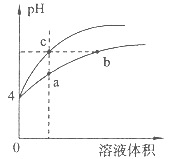
A. a、c两点溶液的导电能力相同
B. b点溶液中c(H+)+c(NH3·H2O)=c(OH-)
C. a、b、c三点溶液中水的电离程度a>b>c
D. 用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb=Vc
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】痛风是关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:
① HUr(尿酸,aq) ![]() Ur-(尿酸根,aq)+H+(aq) (37℃时,Ka =4.0×10-6)
Ur-(尿酸根,aq)+H+(aq) (37℃时,Ka =4.0×10-6)
②NaUr(s) ![]() Ur-(aq)+Na+(aq)
Ur-(aq)+Na+(aq)
(1)37℃时,1.0L水中可溶解8.0×10-3mol尿酸钠,此温度下尿酸钠的Ksp为________。
(2)关节炎发作大都在脚趾和手指的关节处,这说明温度降低时,反应②的Ksp______(填“增大”、“减小”或“不变”),生成尿酸钠晶体的反应是_______(填“放热”或“吸热”)反应。
(3)37℃时,某病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3mol/L,其中尿酸分子的浓度为5.0×10-4mol/L,该病人尿液的c(H+)为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com